
Wetenschap
Wat is de reactievergelijking tussen NH3 en HNO3?
NH₃ (aq) + hno₃ (aq) → nh₄no₃ (aq)
Hier is een uitsplitsing:
* NH₃ (aq): Ammoniak opgelost in water (waterige oplossing)
* hno₃ (aq): Salpeterzuur opgelost in water (waterige oplossing)
* nh₄no₃ (aq): Ammoniumnitraat opgelost in water (waterige oplossing)
Verklaring:
* Ammoniak (NH₃) is een zwakke basis, wat betekent dat het protonen accepteert (H⁺).
* Salpeterzuur (HNO₃) is een sterk zuur, wat betekent dat het gemakkelijk protonen doneert (H⁺).
* Wanneer ze reageren, wordt het proton van HNO₃ overgebracht naar het ammoniakmolecuul, waardoor het ammoniumion wordt gevormd (NH₄⁺).
* Het resterende nitraation (NO₃⁻) combineert met het ammoniumion, resulterend in de vorming van ammoniumnitraat (NH₄NO₃).
Deze reactie is een voorbeeld van een zuur-base neutralisatiereactie, waarbij het zuur en de basis reageren op een zout (ammoniumnitraat) en water. Het water wordt niet expliciet weergegeven in de vergelijking omdat het al aanwezig is in de oplossingen.
 PH niveau van regenwater
PH niveau van regenwater
Regenwater is van nature enigszins zuur, met een pH van ongeveer 5,0. Natuurlijke variaties en menselijke vervuilers kunnen ervoor zorgen dat de regen zuurder wordt. Afhankelijk van de regio, het seizoen en de aanwezigheid
 Wat zijn de belangrijkste bronnen van chloorradicalen?
Wat zijn de belangrijkste bronnen van chloorradicalen?  Wat is de molariteit van een oplossing die 93,5 g kaliumchloride bevat opgelost in een oplossing van 500 ml?
Wat is de molariteit van een oplossing die 93,5 g kaliumchloride bevat opgelost in een oplossing van 500 ml?  Hoe wordt de temperatuur gebruikt om een faseverandering te herkennen?
Hoe wordt de temperatuur gebruikt om een faseverandering te herkennen?  Mengregels voor 3D-printbot
Mengregels voor 3D-printbot
Hoofdlijnen
- Hoe bacteriële cellen hun eigen DNA herkennen
- 2 kiwivogels zijn zeldzaam lichtpuntje in grimmig uitstervingsrapport
- Wat zijn de aanpassingen van een sinaasappelboom?
- Onderwaterkwekerijen helpen de mediterrane visbestanden nieuw leven in te blazen
- Wat is voedselgewas?
- Een schakelaar voor de interne klok:onderzoek naar kwantumbiologie voor nieuwe medische therapieën
- Wetenschappers zeggen dat een One Health-benadering van plantgezondheid van vitaal belang is voor het bereiken van duurzame wereldwijde voedselzekerheid
- Intron: definitie, functie en belang bij RNA-splitsing
- 30 miljoen jaar oude amfibische beverfossiel is oudste ooit gevonden
- Snelle ontwerpmethode voor mini-eiwitten opent de weg om een nieuwe klasse geneesmiddelen te creëren

- Beste prestaties van organisch materiaal voor lithiumbatterijanode met behulp van materiaalinformatica
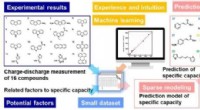
- Sulphur biedt veelbelovend batterij-alternatief van de volgende generatie
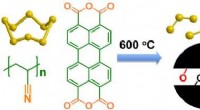
- Onderzoekers zorgen ervoor dat neurale netwerken met succes DNA-schade door UV-straling detecteren
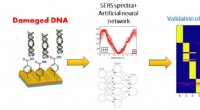
- Cellen construeren levende composietpolymeren voor biomedische toepassingen
 Wat is de chemische vergelijking voor lood(2)nitraat, koper(2)sulfaat levert nitraat op?
Wat is de chemische vergelijking voor lood(2)nitraat, koper(2)sulfaat levert nitraat op?  Welke titel beschrijft het huidige geologische tijdperk het beste?
Welke titel beschrijft het huidige geologische tijdperk het beste?  Wat is de bron van kleine moleculen die worden gebruikt bij het maken van synthetische polymeren?
Wat is de bron van kleine moleculen die worden gebruikt bij het maken van synthetische polymeren?  Wat is de afstand van de zon tot Mercurius?
Wat is de afstand van de zon tot Mercurius?  Wat zijn veronderstellingen die wetenschappers maken over de natuurlijke wereld?
Wat zijn veronderstellingen die wetenschappers maken over de natuurlijke wereld?  Welke energie wordt getransformeerd in een hete plaat?
Welke energie wordt getransformeerd in een hete plaat?  Functies vernietigen
Functies vernietigen Hoe kunt u het woord subscript in een zin gebruiken?
Hoe kunt u het woord subscript in een zin gebruiken?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

