
Wetenschap
De verhoudingen van de reactanten en producten die betrokken zijn bij een chemische reactie worden getoond door welke gebalanceerde vergelijking die de reactie beschrijft?
Dit is waarom:
* Chemische vergelijking: Een chemische vergelijking maakt gebruik van symbolen en formules om de reactanten en producten weer te geven die betrokken zijn bij een chemische reactie.
* balanceren: De vergelijking wordt gebalanceerd door de coëfficiënten (de getallen voor de chemische formules) aan te passen om ervoor te zorgen dat het aantal atomen van elk element aan de reactantzijde (links) gelijk is aan het aantal atomen van dat element aan de productzijde (rechts).
Voorbeeld:
De reactie van waterstofgas (H₂) met zuurstofgas (O₂) om water te produceren (H₂o) wordt weergegeven door de volgende gebalanceerde vergelijking:
2h₂ + o₂ → 2h₂o
Verklaring:
* reactanten: 2 moleculen waterstofgas (H₂) en 1 molecuul zuurstofgas (O₂)
* Producten: 2 watermoleculen (H₂o)
* balanceren: De coëfficiënten (2, 1 en 2) zorgen ervoor dat er 4 waterstofatomen en 2 zuurstofatomen zijn aan beide zijden van de vergelijking.
Dit evenwicht weerspiegelt de wet van het behoud van massa, die stelt dat het er niet in kan worden gecreëerd of vernietigd in een chemische reactie. De evenwichtige vergelijking toont aan dat de totale massa van de reactanten gelijk is aan de totale massa van de producten.
 Heeft elk stuk mineraal dezelfde kristalstructuur?
Heeft elk stuk mineraal dezelfde kristalstructuur?  Welke factoren beïnvloeden de gasuitwisseling bij mensen?
Welke factoren beïnvloeden de gasuitwisseling bij mensen?  Wetenschap op het raakvlak:bio-geïnspireerde materialen onthullen nuttige eigenschappen
Wetenschap op het raakvlak:bio-geïnspireerde materialen onthullen nuttige eigenschappen Nieuw gesynthetiseerde AM-III-koolstof is tot nu toe het hardste en sterkste amorfe materiaal
Nieuw gesynthetiseerde AM-III-koolstof is tot nu toe het hardste en sterkste amorfe materiaal Chloor smelt bij 172 K Wat is het smeltpunt van chloor?
Chloor smelt bij 172 K Wat is het smeltpunt van chloor?
 Geef de bosbranden in Californië niet de schuld van een perfecte storm van weersomstandigheden
Geef de bosbranden in Californië niet de schuld van een perfecte storm van weersomstandigheden Luchtvervuiling beïnvloedt boomgroei in Sao Paulo
Luchtvervuiling beïnvloedt boomgroei in Sao Paulo Hoe de grootte en vorm van gedroogde bladeren kleine vlammen kunnen veranderen in kolossale bosbranden
Hoe de grootte en vorm van gedroogde bladeren kleine vlammen kunnen veranderen in kolossale bosbranden Wat is een landbries veroorzaakt?
Wat is een landbries veroorzaakt?  Redactioneel:Het andere dat we moeten doen om de planeet te redden:minder vlees eten
Redactioneel:Het andere dat we moeten doen om de planeet te redden:minder vlees eten
Hoofdlijnen
- De fysieke toestand van een soort materie hangt vooral af van wat?
- Welke producten ATP?
- Wat zijn de soorten stamcellen?
- Wat is de relatie tussen DNA RNA en eiwitsynthese?
- Welke cellen reproduceren zich door ontluikende gist?
- De chaos van narwalgedrag ophelderen
- Het team laat zien hoe dynamine membraanvernauwing en -splitsing bemiddelt
- P53 (TP53) Tumor Protein: Function, Mutation
- Wat gebeurt er met plantaardige en dierlijke cellen wanneer ze worden geplaatst in hypertone, hypotone en isotone omgevingen?
- Onderzoekers ontdekken proces om psilocybine duurzaam te produceren een kandidaat-geneesmiddel dat kan helpen bij de behandeling van depressie

- Voorgestelde technische methode kan gebouwen en bruggen veiliger maken
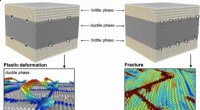
- Biochemicus ontdekt veelbelovend enzym om kankercellen te bestrijden
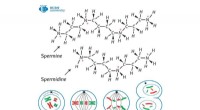
- Maken of breken:nieuwe omkeerbare techniek produceert acylfluoride met behulp van zeldzaam metaal

- Synergie voor opslag:al duizenden jaren kernafval bevatten

 Hoeveel hitte in een kilowatt-uren van een zonnedeler produceren ze?
Hoeveel hitte in een kilowatt-uren van een zonnedeler produceren ze?  Hoe bouw je een Atom Science Project
Hoe bouw je een Atom Science Project  Hagedisschedelfossiel is een nieuwe en verbijsterende uitgestorven soort
Hagedisschedelfossiel is een nieuwe en verbijsterende uitgestorven soort Een vleugje goud verbetert microlasers
Een vleugje goud verbetert microlasers Maat voor de energie of hitte materie?
Maat voor de energie of hitte materie?  Is smeltende boter een chemische stof of fysiek?
Is smeltende boter een chemische stof of fysiek?  Afbeelding:Tinten in een kraterhelling van Mars
Afbeelding:Tinten in een kraterhelling van Mars Is er iets speciaals aan de zon?
Is er iets speciaals aan de zon?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

