
Wetenschap
De energie die nodig is om de bindingen te verbreken in 1 mol van een chemische verbinding?
Hier is een uitsplitsing:
* Bond Enthalpy: Dit is de gemiddelde energie die nodig is om een bepaald type binding in een gasfasemolecuul te verbreken. Het is een positieve waarde omdat energie moet worden geplaatst om de binding te verbreken.
* Bond Dissociation Enthalpy: Dit is de energie die nodig is om een specifieke binding in een molecuul te doorbreken, en deze kan variëren afhankelijk van het specifieke molecuul en de omgeving.
Sleutelpunten:
* eenheden: Bond Enthalpy en Bond Dissociation Enthalpy worden meestal uitgedrukt in kilojoule per mol (kj/mol) .
* Gemiddeld: Bond -enthalpie is een gemiddelde waarde, omdat de werkelijke energie die nodig is om een specifieke binding te breken enigszins kan variëren.
* gasfase: Bond -enthalpieën worden meestal gemeten in de gasfase, omdat intermoleculaire interacties in vloeistoffen en vaste stoffen de bindingssterkten kunnen beïnvloeden.
* Voorspelling van reacties: Bond -enthalpieën kunnen worden gebruikt om de enthalpieverandering (geabsorbeerd of vrijgegeven warmte) te schatten tijdens een chemische reactie.
Laat het me weten als je meer informatie wilt over obligatie -enthalpieën of specifieke voorbeelden wilt verkennen!
 Is C2H5OH een zuurbasiszout of moleculaire verbinding?
Is C2H5OH een zuurbasiszout of moleculaire verbinding?  Machine learning gaat dieper in op katalysatorinteracties om de ontwikkeling van materialen te versnellen
Machine learning gaat dieper in op katalysatorinteracties om de ontwikkeling van materialen te versnellen Moet een evenwichtige vergelijking dezelfde verbindingen aan elke kant van vergelijking hebben?
Moet een evenwichtige vergelijking dezelfde verbindingen aan elke kant van vergelijking hebben?  Scheidingschemie:een stap in de richting van groenere metaalrecyclingprocessen
Scheidingschemie:een stap in de richting van groenere metaalrecyclingprocessen Maak een lijst van de volgende bindingen aan waterstof in volgorde van toenemende polariteit C-H O-H al-H N-H?
Maak een lijst van de volgende bindingen aan waterstof in volgorde van toenemende polariteit C-H O-H al-H N-H?
 Verwacht een bovengemiddeld Atlantisch orkaanseizoen, Amerikaanse voorspellers zeggen:
Verwacht een bovengemiddeld Atlantisch orkaanseizoen, Amerikaanse voorspellers zeggen: Amazonebranden:lokale inheemse bevolking laat zien dat vuur duurzaam kan worden gebruikt
Amazonebranden:lokale inheemse bevolking laat zien dat vuur duurzaam kan worden gebruikt Aardbeving treft grensgebied Iran-Irak
Aardbeving treft grensgebied Iran-Irak Wat is een natuurlijk fenomeen dat de temperatuurbereik van de aarde behoudt?
Wat is een natuurlijk fenomeen dat de temperatuurbereik van de aarde behoudt?  Fruitvliegjes:zomerplaag of wetenschappelijk wonder?
Fruitvliegjes:zomerplaag of wetenschappelijk wonder?
Hoofdlijnen
- Nieuwe studie benadrukt de effecten van een wereldwijde strategie om de antibioticaconsumptie in de productie van voedseldieren te verminderen
- Wat voor soort voortplanting kun je afleiden uit een populatie van identieke individuen?
- Komt celafval voort uit activiteiten?
- De manier waarop een cyanobacterie omgaat met ijzerschaarste maakt hem tot het meest succesvolle fotosynthetische organisme op aarde
- Welk kenmerk classificeert Escherichia coli als een levend wezen ondanks zijn extreem kleine formaat?
- Bevat RNA een genetische code?
- Hoe transporteren cellen moleculen over een celmembraan?
- Van welk type cel is Kingdom Animalia gemaakt?
- Hoe de verbazingwekkende reukzin van Afrikaanse olifanten levens kan redden
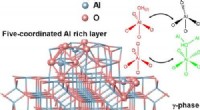
- Aard van vijf-gecoördineerd aluminium op γ-Al2O3-oppervlak
- Het produceren van kunstmest uit lucht zou vijf keer zo efficiënt kunnen zijn
- Nieuwe strategie om katalysatoren met één atoom te fabriceren via elektrochemische depositie

- Video:Waarom je geen verse olijven kunt kopen

- Onderzoekers presenteren inzichten in zoektocht naar nieuwe antibiotica
 Wat zijn satellieten of robots die Neptunus hebben verkend?
Wat zijn satellieten of robots die Neptunus hebben verkend?  Een plotselinge uitbarsting van het oppervlak van een ster zoals zon?
Een plotselinge uitbarsting van het oppervlak van een ster zoals zon?  Had Albert Einstein nobelprijzen voor de natuurkunde?
Had Albert Einstein nobelprijzen voor de natuurkunde?  Een samengestelde machine maken voor een schoolproject
Een samengestelde machine maken voor een schoolproject  Waar in de natuur zijn enzymen gevonden?
Waar in de natuur zijn enzymen gevonden?  Onderzoekers ontdekken dat sommige cidermakers onnodige suiker toevoegen
Onderzoekers ontdekken dat sommige cidermakers onnodige suiker toevoegen Realtime beeldvorming voor gebruik in de geneeskunde
Realtime beeldvorming voor gebruik in de geneeskunde Hoe u geld kunt verdienen met het spelen van een spel
Hoe u geld kunt verdienen met het spelen van een spel
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

