
Wetenschap
Maak een lijst van de volgende bindingen aan waterstof in volgorde van toenemende polariteit C-H O-H al-H N-H?
Polariteit begrijpen
Polariteit in een binding komt voort uit het verschil in elektronegativiteit tussen de twee betrokken atomen. Elektronegativiteit is het vermogen van een atoom om elektronen in een binding aan te trekken. Hoe groter het verschil in elektronegativiteit, hoe meer polair de binding.
elektronegativiteitstrends
* neemt toe over een periode (van links naar rechts): Atomen aan de rechterkant van het periodiek systeem zijn meer elektronegatief.
* vermindert een groep (boven naar beneden): Atomen hoger in een groep zijn meer elektronegatief.
Analyse van de bindingen
1. C-h: Koolstof en waterstof hebben relatief vergelijkbare elektronegativiteiten, wat resulteert in een zeer niet -polaire Bond.
2. al-h: Aluminium is een metaal en heeft een aanzienlijk lagere elektronegativiteit dan waterstof. Dit maakt de binding erg polar , waarbij waterstof het meer elektronegatieve atoom is.
3. N-H: Stikstof is elektronegatiefer dan waterstof, waardoor A polaire ontstaat Bond.
4. O-H: Zuurstof is het meest elektronegatieve atoom van de vier, waardoor de O-H binding de de meeste polaire is van de groep.
het bestellen van de obligaties
Van minimaal tot de meeste polair:
1. C-h (minst polair)
2. n-h
3. al-h
4. O-h (meest polair)
 Waarom transporteert de pijp hete gassen gemaakt van koperen spiraal?
Waarom transporteert de pijp hete gassen gemaakt van koperen spiraal?  Wat zijn ingrediënten van zout water?
Wat zijn ingrediënten van zout water?  Wanneer het lichaam wordt uitgedroogd, wordt er een chemisch signaal verzonden dat ervoor zorgt dat nieren in nieren meer water en uitbreiding zou absorberen. Dit is een voorbeeld van een?
Wanneer het lichaam wordt uitgedroogd, wordt er een chemisch signaal verzonden dat ervoor zorgt dat nieren in nieren meer water en uitbreiding zou absorberen. Dit is een voorbeeld van een?  's Werelds eerste productie van aluminium scandiumnitride via MOCVD
's Werelds eerste productie van aluminium scandiumnitride via MOCVD Kleinschalige engineering kan grote vooruitgang brengen in de medische zorg
Kleinschalige engineering kan grote vooruitgang brengen in de medische zorg
 Welke van uw vijf zintuigen begrijpen wetenschappers het minst goed?
Welke van uw vijf zintuigen begrijpen wetenschappers het minst goed?  NASA-gegevens staren in het oog van krachtige orkaan Lorenzo
NASA-gegevens staren in het oog van krachtige orkaan Lorenzo Sociaal-economisch, milieueffecten van COVID-19 gekwantificeerd
Sociaal-economisch, milieueffecten van COVID-19 gekwantificeerd Onderzoek brengt microplastics in verband met menselijke gezondheidsproblemen, maar er is nog veel dat we niet weten
Onderzoek brengt microplastics in verband met menselijke gezondheidsproblemen, maar er is nog veel dat we niet weten  Indonesië sluit 30 bedrijven af vanwege bosbranden
Indonesië sluit 30 bedrijven af vanwege bosbranden
Hoofdlijnen
- Baanbrekende ontdekking van een geurdetecterende receptorversterker
- Is er een verschil tussen ouder worden en oud worden?
- Wat zijn de functies van glasplaat & dekglaasjes?
- Wat zijn 4 dingen die alle cellen hebben?
- Branch of Science die zich bezighoudt met frequentie- en distributieziekten wordt genoemd?
- Wat betekent conversie als een wetenschapstermijn?
- Welke symbiotische relatie doet mens en e.coli?
- Hoe zorgden dinosaurussen voor botverpletterende beten? Door een stijve onderkaak te houden.
- Ponso helpen, enige overlevende van Chimpansee-eiland in I. Coast
- Chemici vinden manier om bijwerkingen van malariamedicatie te voorkomen

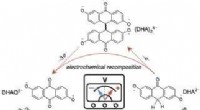
- Onderzoek verlengt de levensduur van moleculen in organische stroombatterijen tot praktische waarden
- Een nieuw potentieel alternatief voor muggenbestrijding ontdekt

- Wetenschappers stellen nieuwe methode voor om atomair gedispergeerde Cu-N-C-katalysator te synthetiseren

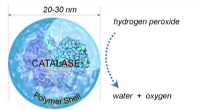
- Gemeenschappelijk antioxidant-enzym kan een mogelijke behandeling bieden voor COVID-19
 Wat zijn de twee stikstofatomen?
Wat zijn de twee stikstofatomen?  Hoeveel subatomaire deeltjes in chloor?
Hoeveel subatomaire deeltjes in chloor?  Wat is de Online Safety Act en waarom hebben rellen in Groot-Brittannië de debatten hierover heropend?
Wat is de Online Safety Act en waarom hebben rellen in Groot-Brittannië de debatten hierover heropend?  ExoMars wetenschappelijke checkout voltooid en aerobraking begint
ExoMars wetenschappelijke checkout voltooid en aerobraking begint Zullen de futures-superbatterijen van zeewater worden gemaakt?
Zullen de futures-superbatterijen van zeewater worden gemaakt? 2 sterke aardbevingen schudden West-Indonesië; geen tsunami
2 sterke aardbevingen schudden West-Indonesië; geen tsunami Het aantal terminals op batterijen?
Het aantal terminals op batterijen?  Waarom wordt wetenschappelijke notatie gebruikt in de wetenschap?
Waarom wordt wetenschappelijke notatie gebruikt in de wetenschap?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

