
Wetenschap
Wat is natriummetalen?
eigenschappen:
* uiterlijk: Zilverachtig wit, zacht en kneedbaar.
* Reactiviteit: Zeer reactief, vooral met water en lucht. Het oxideert gemakkelijk in lucht, vormt natriumoxide (NA2O) en reageert gewelddadig met water, waardoor waterstofgas en natriumhydroxide (NaOH) produceert.
* smeltpunt: 97,72 ° C (207,9 ° F)
* kookpunt: 883 ° C (1621 ° F)
* Dichtheid: 0,968 g/cm³
* elektrische geleidbaarheid: Uitstekende geleider van elektriciteit.
* Thermische geleidbaarheid: Goede dirigent van warmte.
Gebruik:
Vanwege de hoge reactiviteit heeft natriummetaal verschillende toepassingen, waaronder:
* Productie van andere chemicaliën: Het is een belangrijk ingrediënt bij de productie van natriumhydroxide (loog), natriumcarbonaat (wassoda) en natriumcyanide.
* Organische chemie: Gebruikt als een reductiemiddel in organische synthese.
* metalen legeringen: Natrium wordt toegevoegd aan sommige metaallegeringen om hun eigenschappen te verbeteren.
* koelvloeistof in kernreactoren: Vloeibaar natrium is een effectief warmteoverdrachtsmedium.
* Natriumdamplampen: Gebruikt voor straatverlichting vanwege hun efficiënte emissie van geel licht.
Veiligheidsmaatregelen:
Natriummetaal is extreem gevaarlijk vanwege de hoge reactiviteit. Hier zijn enkele veiligheidsmaatregelen:
* hantering: Draag altijd de juiste veiligheidsuitrusting, inclusief handschoenen, bril en een laboratoriumjas.
* opslag: Bewaar natriummetaal onder een laag minerale olie of kerosine om reactie met lucht en vocht te voorkomen.
* Watercontact: Vermijd elk contact met water, omdat dit resulteert in een gewelddadige reactie.
* Vuur: Natriummetaal brandt gemakkelijk in de lucht en kan spontaan ontbranden. Gebruik in het geval van brand een Klasse D -brandblusser.
Samenvattend is natriummetaal een zeer reactief element met veel belangrijke industriële en wetenschappelijke toepassingen. De reactiviteit vereist strikte veiligheidsprotocollen om het veilig te hanteren en op te slaan.
 DNA-replicatie in HPV
DNA-replicatie in HPV Zijn stikstof en zuurstof een homogeen mengsel?
Zijn stikstof en zuurstof een homogeen mengsel?  Als de concentratie van één materiaal in een oplossing wordt gegeven, welke aanvullende informatie is nodig om een tweede oplossing te vinden?
Als de concentratie van één materiaal in een oplossing wordt gegeven, welke aanvullende informatie is nodig om een tweede oplossing te vinden?  3,00 mol No2 heeft een massa van?
3,00 mol No2 heeft een massa van?  Waarom laat het opwarmen van een stof het sneller reageren?
Waarom laat het opwarmen van een stof het sneller reageren?
 NASA-NOAA-satelliet ziet krachtige tropische cycloon Oma die Nieuw-Caledonië treft
NASA-NOAA-satelliet ziet krachtige tropische cycloon Oma die Nieuw-Caledonië treft Ozonafbrekende chemicaliën kunnen minder tijd in de atmosfeer doorbrengen dan eerder werd gedacht
Ozonafbrekende chemicaliën kunnen minder tijd in de atmosfeer doorbrengen dan eerder werd gedacht Magnitude-5.3 aardbeving treft Hawaiis Big Island
Magnitude-5.3 aardbeving treft Hawaiis Big Island India begint aardverschuiving, opruimen van overstromingen terwijl dodelijke moessonregens afnemen
India begint aardverschuiving, opruimen van overstromingen terwijl dodelijke moessonregens afnemen Wat zijn de houding van wetenschappers als ze werken?
Wat zijn de houding van wetenschappers als ze werken?
Hoofdlijnen
- Uit onderzoek blijkt hoe een klein zeedier zichzelf en de oceaan voedt
- Welke organel is de krachtpatser van cel en betrokken bij de energieproductie?
- Hoe worden chromosomen geanalyseerd binnen een karyotype?
- Hoe zorgt de natuurlijke selectie ervoor dat de evolutie optreedt?
- Cellen besteden het grootste deel van hun leven in?
- Hoeveel dennen met bloed bevat het menselijk lichaam?
- Vetzuur: definitie, metabolisme en functie
- Hoe je hersenen werken
- 'Wat als er een stoere Barbie bestond?' Barbie's genderpolitiek onderzocht
- Doorbraak in synthese van scheikundigen bevordert een krachtig middel tegen kanker

- Glanzend gekleurd 3D-printen met vloeibare kristallen

- Een katalytisch ondersteunend materiaal speelt een hoofdrol

- Een betere bouwsteen voor het maken van nieuwe materialen
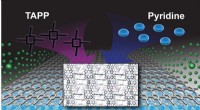
- Nieuwe katalysator voldoet aan de uitdaging om uitlaatgassen van moderne motoren te reinigen

 Cartogramkaarten bieden een nieuwe kijk op het risico van klimaatverandering
Cartogramkaarten bieden een nieuwe kijk op het risico van klimaatverandering Anders dan straling is een nucleaire explosie destructiever conventioneeler met dezelfde opbrengst en manier die energie wordt vrijgegeven die anders worden vrijgegeven in explosie?
Anders dan straling is een nucleaire explosie destructiever conventioneeler met dezelfde opbrengst en manier die energie wordt vrijgegeven die anders worden vrijgegeven in explosie?  Wat is niet -wrijvingskracht?
Wat is niet -wrijvingskracht?  Aardverschuivingen bedreigen de armen in de steden in toenemende mate
Aardverschuivingen bedreigen de armen in de steden in toenemende mate Stress:Hersenen geven aanwijzingen waarom sommigen bezwijken terwijl anderen de overhand krijgen
Stress:Hersenen geven aanwijzingen waarom sommigen bezwijken terwijl anderen de overhand krijgen  Benin springt 21e eeuw binnen met nieuwe nationale kaart
Benin springt 21e eeuw binnen met nieuwe nationale kaart Your Brain On: Empathy
Your Brain On: Empathy Waarom stopt de gevarenknipper op kobalt uit 2005 met knipperen?
Waarom stopt de gevarenknipper op kobalt uit 2005 met knipperen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

