
Wetenschap
Wat is de pH van een 0,280 molaire HCL -oplossing?
Hier leest u hoe u de pH van een 0,280 M HCl -oplossing kunt berekenen:
Inzicht in de concepten
* HCl is een sterk zuur: Dit betekent dat het volledig ioniseert (dissocieert) in water, waardoor al zijn waterstofionen (H+) worden vrijgeeft.
* pH: Een maat voor de zuurgraad of alkaliteit van een oplossing. Het wordt berekend met behulp van de volgende vergelijking:
pH =-log [H+]
Berekening
1. Bepaal de concentratie [H+]: Omdat HCl een sterk zuur is, zal de concentratie van H+ -ionen gelijk zijn aan de concentratie van de HCL -oplossing:
[H+] =0,280 m
2. Bereken de pH:
pH =-log (0.280)
pH ≈ 0,553
Antwoord: De pH van een 0,280 M HCl -oplossing is ongeveer 0,553.
 Fouten in grootschalige, convectieve tropische neerslagsimulaties hebben invloed op klimaatfeedback
Fouten in grootschalige, convectieve tropische neerslagsimulaties hebben invloed op klimaatfeedback Wetenschappers ontdekken hoe gewassen de daglengte gebruiken om te bepalen wanneer ze bloeien
Wetenschappers ontdekken hoe gewassen de daglengte gebruiken om te bepalen wanneer ze bloeien  VN:klimaatverandering ondermijnt werk om armoede te beëindigen, honger
VN:klimaatverandering ondermijnt werk om armoede te beëindigen, honger Nieuwe techniek om broeikasgasproductie door ontdooide permafrost te meten
Nieuwe techniek om broeikasgasproductie door ontdooide permafrost te meten Dodelijke hittegolven onder de radar die Afrika teisteren
Dodelijke hittegolven onder de radar die Afrika teisteren
Hoofdlijnen
- Geef een voorbeeld van wetenschappelijke theorie?
- Wat is de functie van een eicel?
- Kunnen we ons een weg banen door een exploderend zee-egelprobleem?
- Hoe synesthesie werkt
- Wat is een stof die betrokken is bij cellulaire communicatie in het menselijk lichaam?
- Een pittige oplossing voor het herstellen van oesterriffen
- Onderzoekers ontdekken hoe fruitvliegjes leren om reeds bevruchte vrouwtjes te omzeilen
- Hoe ontwikkelen Candida auris en andere schimmels resistentie tegen geneesmiddelen? Een microbioloog legt het uit
- Hoe vergif Sumac te behandelen?
- Op maat gemaakte verharding van bulkmetaalglas veroorzaakt door 2-D gradiëntverjonging
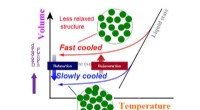
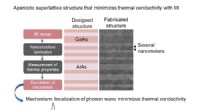
- Minimaliseren van thermische geleidbaarheid van kristallijn materiaal met optimale nanostructuur
- Onderzoekers ontwikkelen een efficiënte, energiezuinige methode voor het upcyclen van polyethyleen plastic afval tot waardevolle moleculen

- Een stap op weg naar betere therapieën tegen virussen
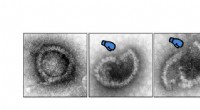
- DNAzymes zouden beter kunnen presteren dan eiwitenzymen voor genetische manipulatie

 Wat vormt kolenolie en gasverbranding?
Wat vormt kolenolie en gasverbranding?  Wat is het doel van het beschermen van gas in GTAW?
Wat is het doel van het beschermen van gas in GTAW?  Onderzoekers nemen tips van Twister om ongrijpbare stormgegevens op te sporen
Onderzoekers nemen tips van Twister om ongrijpbare stormgegevens op te sporen Met framework voor videostreaming kunnen gebruikers gezamenlijk inhoud downloaden
Met framework voor videostreaming kunnen gebruikers gezamenlijk inhoud downloaden Welke landvormen vormen aardbevingen?
Welke landvormen vormen aardbevingen?  Hoe kunnen massa en kracht worden gewijzigd verhoogt de versnelling?
Hoe kunnen massa en kracht worden gewijzigd verhoogt de versnelling?  Wordt Wyoming als een woestijnklimaat beschouwd?
Wordt Wyoming als een woestijnklimaat beschouwd?  Hoe voetbalvormige moleculen voorkomen in het universum
Hoe voetbalvormige moleculen voorkomen in het universum
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

