
Wetenschap
Wat is de moleculaire geometrie van CS2?
Dit is waarom:
* centraal atoom: Koolstof (C) is het centrale atoom.
* valentie -elektronen: Koolstof heeft 4 valentie -elektronen en zwavel heeft elk 6 valentie -elektronen.
* binding: Koolstof vormt dubbele bindingen met elk zwavelatoom, met behulp van twee van zijn valentie -elektronen voor elke binding.
* elektronenparen: Dit laat geen eenzame paar elektronen op het koolstofatoom achter.
* vSEPR -theorie: Volgens de VSEPR (Valent Shell Electron Pair -afstoting) theorie zal het elektronenparen rond het centrale atoom zich regelen om afstoting te minimaliseren. In dit geval, met twee bindingsparen en geen eenzame paren, is de meest stabiele opstelling lineair, met de zwavelatomen aan weerszijden van het koolstofatoom.
Daarom is de moleculaire geometrie van CS₂ lineair, met een bindingshoek van 180 graden.
 Hoe mosselen ijsvrij blijven in een ijskoude wereld
Hoe mosselen ijsvrij blijven in een ijskoude wereld Hoe kunt u de kristalstructuur van een vaste stof bepalen?
Hoe kunt u de kristalstructuur van een vaste stof bepalen?  De voetafdruk verkleinen van een broeikasgas dat krachtiger is dan koolstofdioxide
De voetafdruk verkleinen van een broeikasgas dat krachtiger is dan koolstofdioxide Bloed ruilen voor spuug om te helpen bij gemakkelijke gezondheidsmonitoring thuis
Bloed ruilen voor spuug om te helpen bij gemakkelijke gezondheidsmonitoring thuis  Wat is de juiste reactiewarmte voor samenstelling Twee mol water?
Wat is de juiste reactiewarmte voor samenstelling Twee mol water?
 Mineralenpotentieel van zeldzame aardelementen in de zuidoostelijke kustvlakte van de VS
Mineralenpotentieel van zeldzame aardelementen in de zuidoostelijke kustvlakte van de VS NASA meet regenval in tropische cycloon Maarutha
NASA meet regenval in tropische cycloon Maarutha Spinnen die eruit zien als bruine kluizenaars Spinnen
Spinnen die eruit zien als bruine kluizenaars Spinnen Ploegen, mulchen of direct zaaien:modellering van bodemstructuurveranderingen als belangrijk fundamenteel onderzoek
Ploegen, mulchen of direct zaaien:modellering van bodemstructuurveranderingen als belangrijk fundamenteel onderzoek Nieuwe aanwijzingen helpen verklaren waarom PFAS-chemicaliën weerstand bieden aan sanering
Nieuwe aanwijzingen helpen verklaren waarom PFAS-chemicaliën weerstand bieden aan sanering
Hoofdlijnen
- Een eenvoudig diermodel laat zien hoe omgeving en toestand worden geïntegreerd om gedrag te controleren
- Herintroductie van inheemse zoogdieren helpt dorre landschappen te herstellen
- Het verzamelen van levende slangen in afgelegen Amazonegebieden voor onderzoek is geen gemakkelijke taak; dit is hoe we dat doen
- Het plan om Catalina Island-herten te doden met behulp van scherpschutters in helikopters wordt tegengewerkt door LA County
- Wat is bijvoorbeeld een regulerend voedsel?
- Een besmettelijke ziekte is een die door wat veroorzaakt?
- Onderzoeken hoe toekomstige biologieleraren debatteren over controversiële kwesties
- Nieuw onderzoek naar waarom plantenweefsels een gevoel van richting hebben
- Wat is een boom met fruit die eruit ziet als ronde hersenen?
- Nieuwe strategie voor metabolische engineering verbetert de bioproductie van polymere grondstoffen
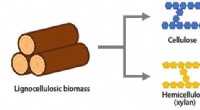
- Chemici leren een enzym een nieuwe truc, met potentieel voor het bouwen van nieuwe moleculen

- Rekbare plastic elektrolyten kunnen een nieuw ontwerp van lithium-ionbatterijen mogelijk maken

- Hoe wetenschappers een nieuwe manier ontdekten om actinium-225 te produceren, een zeldzame medische radio-isotoop
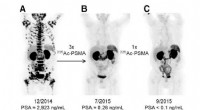
- Sneller giftige kankerverwekkende metalen vinden in voedsel en water

 Brandstofcel zorgt voor een frisse wind voor toekomstig stroomalternatief
Brandstofcel zorgt voor een frisse wind voor toekomstig stroomalternatief Hoe vergelijk ik 4140 & 4150 staal?
Hoe vergelijk ik 4140 & 4150 staal?  Wat zijn de nadelen van vloeibare energiemolen?
Wat zijn de nadelen van vloeibare energiemolen?  Onderzoekers onthullen op oxygenaat gebaseerde routes bij de omzetting van syngas via bifunctionele oxide-zeolietkatalysatoren
Onderzoekers onthullen op oxygenaat gebaseerde routes bij de omzetting van syngas via bifunctionele oxide-zeolietkatalysatoren Noem een gas dat vrijkomt als bijproduct van de lichtafhankelijke reacties fotosynthese?
Noem een gas dat vrijkomt als bijproduct van de lichtafhankelijke reacties fotosynthese?  Florida koralen vertellen over koude periodes en stofkommen voorbij, voorspellen weer te komen
Florida koralen vertellen over koude periodes en stofkommen voorbij, voorspellen weer te komen Een dubbele covalente chemische binding vertegenwoordigt het delen van hoeveel electdrons?
Een dubbele covalente chemische binding vertegenwoordigt het delen van hoeveel electdrons?  3.216 kg is gelijk aan hoeveel pond?
3.216 kg is gelijk aan hoeveel pond?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

