
Wetenschap
Hoe vind je de lading van stikstof?
1. Elementaire stikstof:
* In zijn elementaire toestand (n₂) bestaat stikstof als een diatomee molecuul. Elk stikstofatoom heeft geen lading (neutrale).
2. Ionen:
* Stikstof kan ionen vormen met een negatieve lading. De meest voorkomende ion is nitride (n³⁻) , die een lading van -3 heeft. Dit komt omdat stikstof nog drie elektronen nodig heeft om een stabiele octetconfiguratie te bereiken.
3. Verbindingen:
* In verbindingen kan stikstof verschillende ladingen hebben, afhankelijk van de andere atomen waaraan het is gebonden.
* Om de lading van stikstof in een verbinding te bepalen, kunt u de volgende regels gebruiken:
* De som van de ladingen in een neutrale verbinding moet gelijk zijn aan nul.
* De lading van een monatomisch ion is gelijk aan het groepsnummer min 18.
Voorbeeld:
Laten we het voorbeeld van ammoniak (NH₃) nemen:
* Waterstof (H) heeft een lading van +1.
* De verbinding is neutraal.
* Daarom moet de lading van stikstof (N) -3 zijn om de +3 lading van de drie waterstofatomen in evenwicht te brengen.
4. Oxidatie stelt:
* Oxidatietoestanden zijn een manier om de schijnbare lading van een atoom in een verbinding weer te geven, maar ze vertegenwoordigen niet noodzakelijk de werkelijke lading.
* Stikstof kan oxidatietoestanden hebben variërend van -3 tot +5.
Sleutelpunten:
* De lading van stikstof is afhankelijk van de chemische omgeving.
* In zijn elementaire toestand heeft stikstof geen lading.
* Stikstof vormt gewoonlijk het nitride -ion (n³⁻).
* In verbindingen kan de lading van stikstof worden bepaald met behulp van ladingsbalanceringsregels.
Als u mij een specifieke verbinding of situatie geeft, kan ik u helpen de lading van stikstof in dat geval te bepalen.
Hoofdlijnen
- Uit robotsondes blijkt dat de schoonmaak van de Japanse reactor slechter is dan verwacht
- Wat genereert het grootste deel van de CO geproduceerd door cellulaire ademhaling?
- Wat is een biologisch zuurstofverbruik?
- Wat is oogenisis?
- Vreemde wereld van Australische bijen:hoe één soort genderevenwicht in het nest creëert
- Welke hormonen regelen de secretie van FSH?
- Wat kunnen wetenschappers leren van wormen die gloeien in het donker? De geheimen van regeneratie om te beginnen
- Microbiële structuren in het Antarctische meer zouden meer kunnen onthullen over hoe het leven zich ontwikkelde
- Welke structuur regelt de doorgang van stoffen in en uit cel?
- Hoe robotwiskunde en smartphones onderzoekers naar een doorbraak in de ontdekking van medicijnen hebben geleid

- Het produceren van kunstmest uit lucht zou vijf keer zo efficiënt kunnen zijn
- Nieuw model beschrijft fasescheiding die antilichaamoplossingen bederft
- Nieuw algoritme zorgt voor snellere, diervrije chemische toxiciteitstesten

- Verborgen vervormingen leiden tot veelbelovende thermo-elektrische eigenschappen

 Waarom kunnen koolstof worden gebruikt om koperoxide te extraheren?
Waarom kunnen koolstof worden gebruikt om koperoxide te extraheren?  Onderzoekers onderzoeken hoe stereotypen van oudere volwassenen de juryplicht beïnvloeden
Onderzoekers onderzoeken hoe stereotypen van oudere volwassenen de juryplicht beïnvloeden Duurzaam landbeheer de sleutel tot het verminderen van bosbranden in de Amazone, studie toont
Duurzaam landbeheer de sleutel tot het verminderen van bosbranden in de Amazone, studie toont Onderzoekssamenwerking brengt nieuwe concepten voor kalium-ionbatterijen
Onderzoekssamenwerking brengt nieuwe concepten voor kalium-ionbatterijen Welk proces is verantwoordelijk voor het bouwen van opeenvolgende rotslagen op aarde?
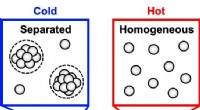
Welk proces is verantwoordelijk voor het bouwen van opeenvolgende rotslagen op aarde?  Is zoutoplossing een homogeen of heterogeen?
Is zoutoplossing een homogeen of heterogeen?  Wat is een voorbeeld van wetenschappelijk onderzoek?
Wat is een voorbeeld van wetenschappelijk onderzoek?  Bidsprinkhanengarnalen zouden ons de weg kunnen wijzen naar een betere dvd
Bidsprinkhanengarnalen zouden ons de weg kunnen wijzen naar een betere dvd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


