
Wetenschap
Waarom lossen ionische verbindingen niet op in organisch oplosmiddel?
* ionische verbindingen: Deze worden bij elkaar gehouden door sterke elektrostatische interacties tussen tegengesteld geladen ionen (kationen en anionen). Ze hebben een hoog smeltpunt en zijn over het algemeen zeer polair vanwege de ongelijke verdeling van elektronen tussen de ionen.
* Organische oplosmiddelen: Deze zijn meestal niet-polair of slechts enigszins polair vanwege de aanwezigheid van koolstofhydrogene bindingen. Ze worden bij elkaar gehouden door zwakkere Van der Waals -krachten.
Waarom ze niet mixen:
* "zoals oplost zoals": Dit principe stelt dat stoffen met vergelijkbare polariteit de neiging hebben om in elkaar op te lossen. Aangezien ionische verbindingen zeer polaire zijn en organische oplosmiddelen over het algemeen niet -polair zijn, hebben ze moeite met interactie en oplossen.
* Energieoverwegingen: Voor een ionische verbinding om op te lossen in een oplosmiddel, moet de energie die nodig is om de ionische bindingen te doorbreken, worden gecompenseerd door de energie die wordt afgegeven door de vorming van nieuwe interacties tussen de ionen en de oplosmiddelmoleculen.
* In organische oplosmiddelen zijn deze nieuwe interacties (ion-dipoolinteracties) zwakker dan de ionische bindingen in de vaste stof.
* Dit betekent dat de energie die wordt vrijgegeven tijdens solvatie onvoldoende is om de sterke ionische bindingen te verbreken, waardoor ontbinding minder gunstig is.
Uitzonderingen:
Hoewel de meeste ionische verbindingen niet oplossen in organische oplosmiddelen, zijn er enkele uitzonderingen:
* Polaire organische oplosmiddelen: Sommige organische oplosmiddelen, zoals ethanol en aceton, hebben een hogere mate van polariteit vanwege de aanwezigheid van zuurstof- of stikstofatomen. Deze kunnen sommige ionische verbindingen oplossen, vooral kleinere met een hoge ladingsdichtheid.
* ionische vloeistoffen: Dit zijn gesmolten zouten met smeltpunten onder 100 ° C. Ze kunnen sommige organische verbindingen oplossen vanwege hun unieke eigenschappen.
Samenvattend: De sterke elektrostatische interacties in ionische verbindingen en de relatief zwakke krachten in organische oplosmiddelen maken oplossing ongunstig. Het "Like Lost LoSt -Like" -principe is van toepassing, en polaire ionische verbindingen mengen over het algemeen niet goed met niet -polaire organische oplosmiddelen.
 Wat zijn grote moleculen gemaakt van koolstof- en waterstofatomen?
Wat zijn grote moleculen gemaakt van koolstof- en waterstofatomen?  Inumiraat de producten van traditionele biotechnolgy?
Inumiraat de producten van traditionele biotechnolgy?  Elk Brønsted Lowry-zuur is ook een Lewis-zuur.?
Elk Brønsted Lowry-zuur is ook een Lewis-zuur.?  Wat gebeurt er met de oplossnelheid als de temperatuur in een gasoplossing toeneemt?
Wat gebeurt er met de oplossnelheid als de temperatuur in een gasoplossing toeneemt?  Onderzoek toont aan dat 3D-covalente organische raamwerken kunnen worden afgestemd met behulp van structurele isomeren
Onderzoek toont aan dat 3D-covalente organische raamwerken kunnen worden afgestemd met behulp van structurele isomeren
 Is iets wat Australiërs doen op het gebied van klimaatverandering van belang?
Is iets wat Australiërs doen op het gebied van klimaatverandering van belang? Wat kunt u verwachten als u elektrisch vervoer verwacht?
Wat kunt u verwachten als u elektrisch vervoer verwacht? Vraag en antwoord:Afvang en opslag van kooldioxide bestuderen tijdens afvalverbranding
Vraag en antwoord:Afvang en opslag van kooldioxide bestuderen tijdens afvalverbranding Voorbeelden van koolstofmoleculen die een rol hebben in het dagelijks leven
Voorbeelden van koolstofmoleculen die een rol hebben in het dagelijks leven Waar zijn de gematigde zones gelegen?
Waar zijn de gematigde zones gelegen?
Hoofdlijnen
- Simulaties laten zien hoe gentherapie effectiever kan worden gemaakt
- Welk phylum zijn orang -oetans?
- Zijn aseksuele sporen in basidiomyceten aanwezig of niet?
- Welke wezens zijn niet geleid?
- Hoe goede stamcellen van slechte te onderscheiden
- Hoe planten defensieve gifstoffen produceren zonder zichzelf schade toe te brengen
- Waarom sommige grassen een efficiëntere fotosynthese ontwikkelden en andere niet
- Waarom vechten dieren tegen leden van andere soorten?
- Hoe wetenschappers DNA-codes herontwerpen
- Wetenschappers vinden handapparaat uit voor snelle bewaking van drinkwaterkwaliteit

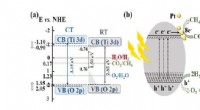
- Nieuwe fotokatalysator versnelt de omzetting van kooldioxide in chemische hulpbronnen
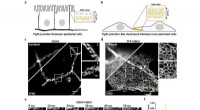
- Dicht en permeabel:moleculaire organisatie van nauwe kruispunten gedecodeerd
- Nieuwe fluoroforen kunnen kanker helpen bestrijden

- Nieuwe technologie zet biomassa om in steenkool

 Leg uit waarom een energiepiramide wordt gebruikt om de hoeveelheid van elk trofisch niveau te vertegenwoordigen?
Leg uit waarom een energiepiramide wordt gebruikt om de hoeveelheid van elk trofisch niveau te vertegenwoordigen?  Wat zijn Northings en Eastings?
Wat zijn Northings en Eastings?  Hoe vind je hoeveel energie wordt overgedragen in een uur joules?
Hoe vind je hoeveel energie wordt overgedragen in een uur joules?  Het aantal mol in een oplossing berekenen
Het aantal mol in een oplossing berekenen Wat is er op de 0 graden Latitude Line?
Wat is er op de 0 graden Latitude Line?  Zoutkracht:watt is de volgende in oplaadbare batterijen?
Zoutkracht:watt is de volgende in oplaadbare batterijen?  Wetenschappers vinden het oudst bekende gefossiliseerde spijsverteringskanaal van 550 miljoen jaar oud
Wetenschappers vinden het oudst bekende gefossiliseerde spijsverteringskanaal van 550 miljoen jaar oud Wetenschappers:wind, droogte verergert branden, geen slecht management
Wetenschappers:wind, droogte verergert branden, geen slecht management
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

