
Wetenschap
Natrium heeft één elektron in zijn buitenste schaal volgens de octetregel?
Dit is waarom dit relevant is voor de octetregel:
* De octetregel: Atomen hebben de neiging om elektronen te winnen, verliezen of delen om een stabiele elektronenconfiguratie te bereiken met acht elektronen in hun buitenste schaal (zoals edelgassen).
* Natriumsituatie: Natrium heeft slechts één elektron in zijn buitenste schaal (3S¹). Om een stabiel octet te bereiken, is het voor natrium veel gemakkelijker om * dat ene elektron te verliezen. Wanneer het dit elektron verliest, wordt het een positief geladen ion (Na⁺) met een volledige buitenste schaal (2S², 2P⁶) zoals neon (NE).
Samenvattend volgt natrium de octetregel niet in zijn neutrale toestand, maar het bereikt wel een stabiele octetconfiguratie door een positief ion te vormen.
 Nooit meer met vuur spelen:onderzoek biedt inzicht in veiligere oplaadbare batterijen
Nooit meer met vuur spelen:onderzoek biedt inzicht in veiligere oplaadbare batterijen Wat is het woordvergelijking voor het verbranden van ijzerwol in zuivere zuurstof om oxide te produceren?
Wat is het woordvergelijking voor het verbranden van ijzerwol in zuivere zuurstof om oxide te produceren?  Wat converteert stikstof in een bruikbare stof tijdens de cyclus?
Wat converteert stikstof in een bruikbare stof tijdens de cyclus?  Waarom is de pH-schaal 1-14 en niet 1-10 of iets intuïtiever?
Waarom is de pH-schaal 1-14 en niet 1-10 of iets intuïtiever?  Waarom veranderen planten zonlicht CO2 en water in suikerzuurstof?
Waarom veranderen planten zonlicht CO2 en water in suikerzuurstof?
 Een stof heeft altijd eigenschappen, ook al zijn deze moeilijk waar te nemen?
Een stof heeft altijd eigenschappen, ook al zijn deze moeilijk waar te nemen?  De ontdekking van een hybride afstammingslijn biedt aanwijzingen voor hoe bomen de klimaatverandering aanpassen
De ontdekking van een hybride afstammingslijn biedt aanwijzingen voor hoe bomen de klimaatverandering aanpassen  Smeltend zee-ijs kan leiden tot meer leven in de zee
Smeltend zee-ijs kan leiden tot meer leven in de zee NASA ziet krachtige orkaan Willa die West-Mexico treft
NASA ziet krachtige orkaan Willa die West-Mexico treft Uit onderzoek blijkt dat de stabiliteit van de wateropbrengst in stroomgebieden afneemt
Uit onderzoek blijkt dat de stabiliteit van de wateropbrengst in stroomgebieden afneemt
Hoofdlijnen
- Hongerige berencrisis grijpt in het verre oosten van Rusland
- Waarom doneren supermarkten voedsel? Omdat het goed is voor het bedrijfsresultaat
- Vogelgriep bij rundvee:wat zijn de zorgen rond het nieuw opkomende rundergriepvirus H5N1?
- Lijst met schimmelvoordelen
- Celmuursamenstelling van de zes koninkrijken
- Zijn mensen het slimste dier?
- Hoe heeft Theodor Schwan bijgedragen aan de celtheorie?
- Hoe breidt DNA uit?
- Hoe vaak meerdere bacteriën meerdere?
- Het degradatiegedrag van geavanceerde medische apparaten voorspellen

- Nieuwe chip meet meerdere cellulaire reacties om het ontdekken van medicijnen te versnellen

- Kankercellen van patiënten groeien betrouwbaar op nieuwe 3D-steiger, veelbelovend voor precisiegeneeskunde
- Elektrodeontwerp maakt de weg vrij voor betere biobrandstofcellen, elektrochemische apparaten
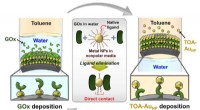
- Chemici leren hoe ze fenolen in gerookte voedselmonsters kunnen detecteren met behulp van vitamine B4

 Zou een grote tsunami ooit de Verenigde Staten kunnen treffen?
Zou een grote tsunami ooit de Verenigde Staten kunnen treffen?  Mars Curiositys-labs zijn weer in actie
Mars Curiositys-labs zijn weer in actie Kunnen hennep nanosheets grafeen omverwerpen om de ideale supercondensator te maken?
Kunnen hennep nanosheets grafeen omverwerpen om de ideale supercondensator te maken? UA maakt deel uit van een groep die ontrafelt hoe de hersenen het geheugen beheren
UA maakt deel uit van een groep die ontrafelt hoe de hersenen het geheugen beheren  Populaire Porsche SUV om elektrisch te gaan
Populaire Porsche SUV om elektrisch te gaan Wat is de functie van cuticula?
Wat is de functie van cuticula?  Hoe gelukkig te zijn in een relatie
Hoe gelukkig te zijn in een relatie  Wetenschappers richten zich op kankerbehandelingen met CRISPR
Wetenschappers richten zich op kankerbehandelingen met CRISPR
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

