
Wetenschap
Valence lithium natrium reageren ze op vergelijkbare manieren?
overeenkomsten:
* Hoge reactiviteit: Zowel lithium als natrium zijn zeer reactieve metalen, die gemakkelijk reageren met water, zuurstof en andere elementen.
* Vorming van ionen: Beide elementen hebben de neiging om één elektron te verliezen om een +1 kation te vormen (Li+en Na+).
* Vorming van zouten: Ze vormen zouten met verschillende anionen, zoals haliden, sulfaten en carbonaten.
Verschillen:
* Reactiviteit met water: Lithium reageert langzamer met water dan natrium. Natrium reageert krachtig en explosief met water, terwijl lithium zachter reageert en waterstofgas produceert.
* reactiviteit met zuurstof: Lithium vormt lithiumoxide (li₂o) bij blootstelling aan lucht, terwijl natrium natriumoxide (Na₂o) en natriumperoxide (Na₂o₂) vormt.
* smelt- en kookpunten: Lithium heeft een hoger smeltpunt en kookpunt dan natrium.
* Dichtheid: Natrium is minder dicht dan lithium, wat betekent dat het lichter is.
* vlamkleur: Wanneer ze verbrand zijn, produceert lithium een karmozijnrode rode vlam, terwijl natrium een felgele vlam produceert.
Samenvattend: Terwijl lithium en natrium enkele vergelijkbare chemische eigenschappen delen, verschillen hun reactiviteit en andere kenmerken aanzienlijk. Deze verschillen komen voort uit hun verschillende elektronenconfiguraties en atoomgroottes.
Opmerking: Het is belangrijk om zowel lithium als natrium met extreme voorzichtigheid te behandelen vanwege hun hoge reactiviteit en potentieel voor brand en explosie.
 Hoe te onderscheiden tussen een koe en een stier Moose
Hoe te onderscheiden tussen een koe en een stier Moose Lorenzo nu een meer georganiseerde en krachtige orkaan op NASA-satellietbeelden
Lorenzo nu een meer georganiseerde en krachtige orkaan op NASA-satellietbeelden Hoe komt neerslag op en wat bepaalt het type perceptie dat op de aarde valt?
Hoe komt neerslag op en wat bepaalt het type perceptie dat op de aarde valt?  Voorbeelden van marine-voedselketens
Voorbeelden van marine-voedselketens Hoe Zeldzame eetbare paddestoelen te vinden gevonden in Ohio
Hoe Zeldzame eetbare paddestoelen te vinden gevonden in Ohio
Hoofdlijnen
- Wat is er een onafhankelijk of afzonderlijk bestaan?
- G1-fase: wat gebeurt er tijdens deze fase van de celcyclus?
- Evolueert de mens sneller? Uit onderzoek blijkt dat we steeds meer verschillend worden, en niet meer hetzelfde
- Studie identificeert walvisblaasmicrobioom
- Uit onderzoek blijkt dat eekhoorns op latere leeftijd profiteren van een voedselhausse die de tegenslagen in hun vroege levensjaren teniet doet
- Onderzoeksteam kijkt naar het verleden voor inzichten over de toekomst van megafauna
- Wetenschappers ontwikkelen een techniek om RNA-structuren in ultrahoge definitie te analyseren
- Oude genomen uit de Andes vertonen duidelijke aanpassingen aan landbouw en hoogte
- Hoe invasieve regenwormen ecosystemen schaden
- Apparaat verandert schelpen van zeedieren in kracht voor medische, augmented reality, mobiele apparaten

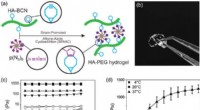
- Nieuwe biocompatibele hybride hydrogels met indrukwekkende mechanische eigenschappen

- Onderzoek naar oxidatieve routes in nucleaire brandstof

- 3D-kweken van hepatocyten op een lever-op-een-chip-apparaat
- Moleculair baken signaleert lage zuurstof met ultrageluid

 Wat is eindcelspanning?
Wat is eindcelspanning?  Is de eerste wet van de thermodynamica, stelt dat energie op verschillende manieren kan worden getransformeerd maar nooit kan worden gecreëerd of vernietigd. A.True?
Is de eerste wet van de thermodynamica, stelt dat energie op verschillende manieren kan worden getransformeerd maar nooit kan worden gecreëerd of vernietigd. A.True?  Hoe vormen wij mensen de aarde naast natuurlijke krachten?
Hoe vormen wij mensen de aarde naast natuurlijke krachten?  Hoe chemische reacties worden berekend
Hoe chemische reacties worden berekend Wat is een nadeel van kernenergie?
Wat is een nadeel van kernenergie?  Koude zonnen, warme exoplaneten en methaandekens:model bouwt voort op de erfenis van de zwakke jonge zonneparadoxhypothese
Koude zonnen, warme exoplaneten en methaandekens:model bouwt voort op de erfenis van de zwakke jonge zonneparadoxhypothese Welke warmte -energie overgedragen door een stof door direct moleculair contact?
Welke warmte -energie overgedragen door een stof door direct moleculair contact?  Hoe landschapsplanten de ecologische voetafdruk beïnvloeden
Hoe landschapsplanten de ecologische voetafdruk beïnvloeden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

