
Wetenschap
3D-kweken van hepatocyten op een lever-op-een-chip-apparaat
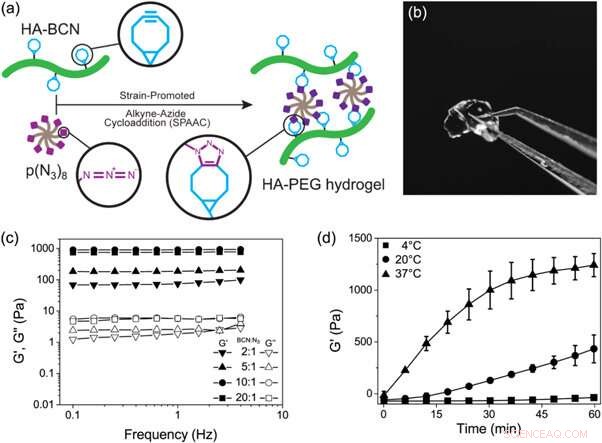
(a) Schematische weergave van de vorming van HA-PEG-hydrogels door een door een stam bevorderde alkyn-azide-cycloadditiereactie. (b) Foto van een HA-PEG-hydrogel na vorming. (c) Frequentiebereiken van HA-PEG-hydrogels met verschillende BCN tot N3-verhoudingen. ( d ) Geleringstijdexperiment dat de toename van G 'in de loop van de tijd laat zien tijdens gelering van HA-PEG-hydrogels (10:1 BCN:N3) bij verschillende temperaturen. Credit: Biofabricage , doi:https://doi.org/10.1088/1758-5090/aaf657
Lever-op-een-chip celkweekapparaten zijn aantrekkelijke biomimetische modellen bij het ontdekken van geneesmiddelen, toxicologisch en weefseltechnisch onderzoek. Om specifieke levercelfuncties op een chip in het lab te behouden, aan adequate celtypen en kweekomstandigheden moet worden voldaan, waaronder 3D-celoriëntatie en een consistente toevoer van voedingsstoffen en zuurstof. Vergeleken met conventionele 2D-celkweektechnieken, organ-on-a-chip-apparaten bieden veelzijdigheid en effectieve biomimicry die geschikt zijn voor geavanceerde toepassingen in de ontdekking van geneesmiddelen en medicijnen.
In een recente studie die nu is gepubliceerd op Biofabricage , Jonas Christoffersson en collega's toonden aan hoe hydrogels die de extracellulaire matrix nabootsen, de functionaliteit en levensvatbaarheid van hepatocyten in een geperfuseerd lever-op-een-chip-apparaat kunnen ondersteunen. De interdisciplinaire onderzoekers van de afdeling biotechnologie en moleculaire fysica ontwierpen een hydrogelsysteem op basis van hyaluronan en poly(ethyleenglycol) (HA-PEG) polymeren. Ze ontwikkelden de hydrogels met behulp van klikchemie. Om het proces mogelijk te maken, de wetenschappers voerden een biorthogonale reactie uit (chemie die plaatsvindt in levende systemen zonder de interferentie van inheemse biochemische reacties) tussen een cyclo-octyngroep en een met alkynazide gelabelde reactiepartner, bekend als stam-promoted alkynazide cycloadditie (SPAAC).
De nieuwe hydrogelmaterialen werden ontwikkeld en gekarakteriseerd in vergelijking met bestaande agarose- en alginaathydrogels voor celcompatibiliteit (cytocompatibiliteit). Voor biofunctionalisatiestudies, de onderzoekers gebruikten humane geïnduceerde-pluripotente stamcel-afgeleide hepatocyten (hiPS-HEP's). Om de oppervlaktecytocompatibiliteit van het biomateriaal te verbeteren, HA-PEG-hydrogels werden gewijzigd met azide-gemodificeerde celadhesiemotieven om effectieve celmateriaalaanhechtingen te vergemakkelijken. In het oppervlaktegefunctionaliseerde biomateriaal, de hepatocytstamcellen migreerden en groeiden in 3D-oriëntaties, met verhoogde levensvatbaarheid. De wetenschappers observeerden een hogere albumineproductie op het nieuwe materiaal (karakteristiek levereiwit), vergeleken met cellen gekweekt op andere hydrogels. De flexibele, SPAAC verknoopt hydrogelsysteem met geperfuseerde 3D-celcultuur van hiPS-HEP's is een veelbelovend materiaal om lever-op-een-chip-apparaten te optimaliseren.
Geminiaturiseerde bioreactoren bekend als 'organ-on-chips', zijn onlangs naar voren gekomen als alternatieve celcultuurmodellen die de in vivo biologische micro-omgeving in het laboratorium beter nabootsen. De lever is een model van speciaal belang in medisch onderzoek vanwege de hepatotoxiciteit van geneesmiddelen die wordt waargenomen in alle fasen van de klinische ontwikkeling van geneesmiddelen. Eerdere publicaties beschrijven het gebruik van organ-on-chips om de uitkomst van de impact van een medicijn in klinische onderzoeken te voorspellen en om geneesmiddelinteracties met hepatocyten in het laboratorium te evalueren.
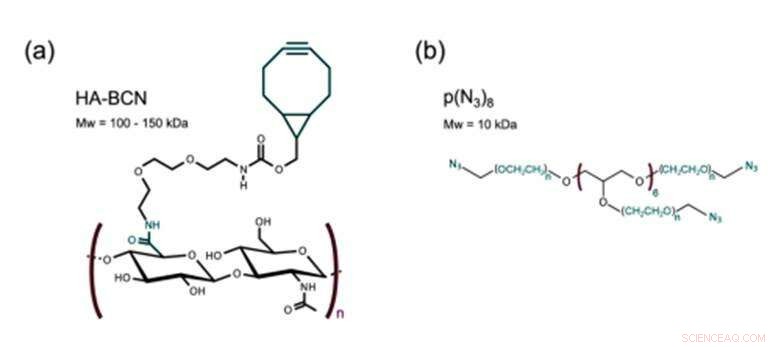
Structuur van a) HA-BCN met een verhouding n/m van 0,19 en b) p(N3)8. Credit: Biofabricage , doi:https://doi.org/10.1088/1758-5090/aaf657
Vanwege hun bredere acceptatie in academische en industriële omgevingen, de bioreactoren vereisen geoptimaliseerde materialen en omstandigheden voor fabricage met een hoge doorvoer. Voorwaarden zijn onder meer het vervangen van het gemeenschappelijke prototypingmateriaal polydimethylsiloxaan (PDMS), integratie van geïnduceerde pluripotente stamcel (iPSC)-afgeleide cellen op een zacht biomateriaal dat hun groei vergemakkelijkt en het grote dode volume minimaliseert dat wordt veroorzaakt door microfluïdische reservoirs en slangen van organ-on-chips-apparaten.
Het nieuwe biomateriaal dat in het onderzoek werd bereid, bevatte twee hoofdbestanddelen die via SPAAC waren verknoopt; een cycloocyten-gemodificeerd hyaluronan (HA-BCN) en een meerarmige azide-gemodificeerde PEG [p(N 3 ) 8 ]. Het BCN reageerde met aziden (N 3 ) op het 8-armige PEG-polymeer met eindigende N 3 - resten om een stabiele 1 te vormen 2, 3-triazool. Christoffersson et al. voltooide chemische reacties onder fysiologische omstandigheden om de hydrogels te vormen met instelbare visco-elastische eigenschappen. De verknopingsstrategie was ideaal om hydrogels te fabriceren voor 3D-celkweek; omdat de cellen in het biomateriaal konden worden ingekapseld zonder hun levensvatbaarheid in gevaar te brengen en geschikt waren voor gebruik in microfluïdische apparaten. De wetenschappers gebruikten overtollige SPAAC-resten op het nieuwe biomateriaal om verschillende liganden te hechten, waaronder RGD-peptiden om interacties op het cel-materiaalinterface te bevorderen.
Daarna, de wetenschappers varieerden de samenstelling van de twee hoofdbestanddelen om de resulterende visco-elastische eigenschappen te begrijpen, zoals de opslagmodulus (G') en verliesmodulus (G") van de hydrogels via oscillerende reologie (techniek om het visco-elastische gedrag van zachte materialen te meten). Ze controleerden de geleringskinetiek van de nieuwe hydrogel bij toenemende temperaturen. het nieuwe biomateriaal was langzaam genoeg voor homogene celdistributie, maar snel genoeg om celsedimentatie te voorkomen.Het vermogen om de geleringskinetiek te controleren, stelde de wetenschappers in staat om een verscheidenheid aan biofabricagestrategieën (bijv. Bioprinting) en hydrogelassemblage binnen de microfluïdische systemen voor orgaan-op- chip toepassingen.
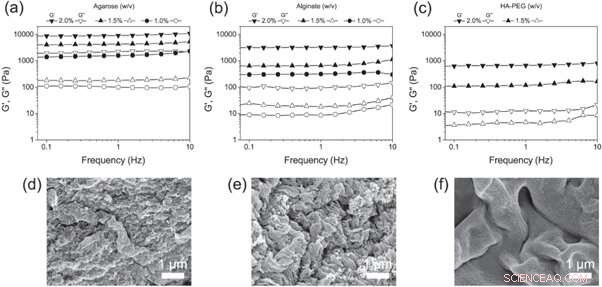
(a)–(c) Frequentiebereiken van (a) agarose, (b) alginaat en (c) HA-PEG-hydrogels in verschillende concentraties. (d) - (f) SEM-microfoto's van (d) agarose, (e) alginaat en (f) HA-PEG-hydrogels die de morfologie van elke hydrogel tonen. Credit: Biofabricage , doi:https://doi.org/10.1088/1758-5090/aaf657
Christoffersson et al. vervolgens vergeleek de HA-PEG-hydrogels met de gevestigde 3D-celcultuursteigers - agarose en alginaathydrogels. Om de uiteindelijke visco-elastische eigenschappen te bepalen die geschikt zijn voor 3D-celkweekexperimenten, ze gebruikten oscillerende reologie om de verschillende polymeerconcentraties te onderzoeken. De wetenschappers analyseerden de samenstelling van de definitieve materialen met behulp van scanning-elektronenmicroscopie (SEM) -beelden.
Het ontwerp en de opstelling van de lever-op-een-chip moesten voldoen aan twee belangrijke criteria in het onderzoek:
1. Laat perfusie (doorgang van vloeistof) van celkweekmedium over het hydrogeloppervlak toe voor een stabiele uitwisseling van voedingsmedia, van en naar de ingekapselde hepatocyten.
2. Sta bemonstering van de geperfundeerde media toe voor experimentele analyse tijdens lopende celcultuur, zonder de hepatocyten en de hydrogel te beïnvloeden.
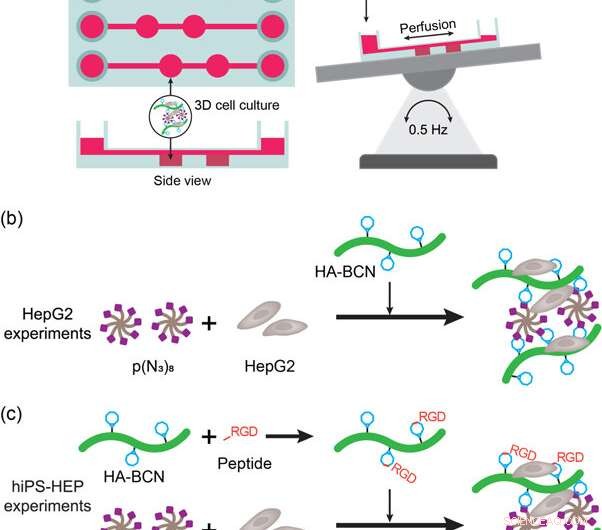
(a) Schematische weergave van het lever-op-een-chip-apparaat en de setup. Het apparaat werd op een automatische schudtafel geplaatst om perfusie van media en voedingsstoffen tijdens celkweek mogelijk te maken. (b) Afbeelding van de HepG2 3D-celkweekexperimenten met HA-PEG-hydrogels. De HepG2-cellen werden toegevoegd aan in media gesuspendeerd p(N3)8 voorafgaand aan toevoeging van HA-BCN. (c) Afbeelding van de hiPS-HEP 3D-celkweekexperimenten met HA-PEG-hydrogels. De hiPS-HEP-cellen werden toegevoegd aan in media gesuspendeerd p(N3)8 voorafgaand aan toevoeging van HA-BCN. In experimenten met linRGD- of cRGD-peptide, de HA-BCN werd gedurende 1 uur voorgeïncubeerd met 1 μM overeenkomstig peptide voordat de HA-BCN(RGD)-component aan het hiPS-HEP/p(N3)8-mengsel werd toegevoegd. Credit: Biofabricage , doi:https://doi.org/10.1088/1758-5090/aaf657
Om aan deze criteria te voldoen, de wetenschappers gebruikten een commercieel 3D-celkweekapparaat (μ-Slide III 3D Perfusion IbiTreat) met twee opeenvolgende kamers (2 x 30 µL) in drie parallelle arrays - elk verbonden met mediareservoirs om vloeistof te perfuseren. Voor een effectieve perfusie, ze monteerden het apparaat op een automatische schommeltafel door de perfusaatrichting over de hydrogelbevattende kamers om te keren. De experimentele opstelling maakte perfusie door het apparaat mogelijk, voldoen aan de eerste criteria. Om aan het tweede criterium te voldoen, de gelokaliseerde wanden naast de hydrogelkamers stelden de wetenschappers in staat om het perfusaat te bemonsteren zonder de hydrogel of celbestanddelen te verstoren.
De wetenschappers onderzochten eerst de biofunctionalisatie van lever-op-een-chip-apparaten in de studie met HEPG2-cellen (levercarcinoomcellijn) ingekapseld in hydrogels, na 3, 7 en 9 dagen celcultuur. Ze vergeleken de celmorfologie, levensvatbaarheid en functionaliteit met agarose en alginaathydrogels. De studie omvatte levende/dood-assays om de levensvatbaarheid van de cellen te bevestigen en bevestigde de HepG2-functionaliteit verder door albumine- en ureumsecreties in het supernatant van de celcultuur te detecteren.
Voor verbeterde celfunctionaliteit (oppervlaktehechting en mobiliteit op materialen), de wetenschappers enten celadhesiemotieven zoals lineaire of cyclische RGD-peptiden (lineaire linRGD of cyclische cRGD) op de hydrogels. Op dit moment, hiPS-HEP-cellen (hepatocytstamcellen) werden gedurende 13 dagen in verschillende hydrogelsamenstellingen gekweekt om de morfologie en levensvatbaarheid (levende/dood-kleuring) na cel-materiaalinteracties te onderzoeken. De wetenschappers gebruikten zes verschillende op hydrogel gebaseerde biomateriaaloppervlakken in de experimenten, waaronder; 2D (HEP-laag), agarose, alginaat, HA-PEG, HA-PEG (linRGD) en HA-PEG (cRGD).
De hiPS-HEP-cellen ingekapseld en gekweekt in de gemodificeerde hydrogel groeiden binnen 2D- en echte 3D-constructies. Om de functionaliteit van de gekweekte hiPS-HEP-cellen (stamcellen) te testen, de wetenschappers kwantificeerden hun albumine- en ureumuitscheiding. De resultaten toonden aan dat alleen de supernatanten van stamcellen gekweekt in 2D-oppervlakken en in aanwezigheid van de cRGD-motiefhydrogels albumine afscheidden.
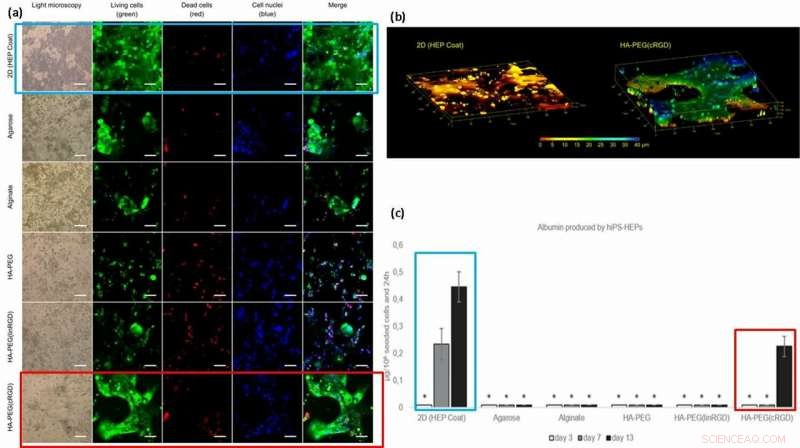
(a) levensvatbaarheid en morfologie van hiPS-HEP-cellen na 13 dagen kweken. De levensvatbaarheid van de cellen lijkt afhankelijk te zijn van het vermogen van de cel om zich aan het oppervlak te hechten, de hydrogel, of naar elkaar. Grote structuren van hiPS-HEP's werden gevormd in HA-PEG (cRGD). (calceïne, groente), dode cellen (ethidium homodimeer-1, rood), en kernen (Hoechst 33 342, blauw). (b) Z-stack van afbeeldingen verkregen door confocale microscopie onthult de platte vorm van hiPS-HEPS wanneer gekweekt op een 2D-substraat (links) in vergelijking met de 3D-constructies van de cellen in een HA-PEG (cRGD) hydrogel (rechts). De kleuren vertegenwoordigen de hoogte boven de bodem van de kamer van het 3D-celkweekapparaat, d.w.z. de Z-as, van 0 m (rood) tot 40 m (blauw). (c) Albumine geproduceerd door hiPS-HEP op HEP Coat in 2D en in de verschillende hydrogels. * geeft aan dat de albumineconcentratie te laag was voor betrouwbare kwantificering. Credit: Biofabricage , doi:https://doi.org/10.1088/1758-5090/aaf657
Op basis van de resultaten, de wetenschappers schreven de hogere hoeveelheid albumine op de 2D HEP-laag toe aan de snelheid van albuminediffusie in hydrogels; overdracht over 2D-laag is sneller dan 3D. De hogere concentratie van albumine met aan cRGD-motief gebonden hydrogels, gecorreleerd met de verhoogde celgroei en levensvatbaarheid waargenomen op de cRGD-gebonden biomateriaaloppervlakken. Als resultaat, de wetenschappers zijn van plan om in de toekomst cyclische vormen van RGD-peptide te gebruiken om hepatocytstamcelkweek te ondersteunen op hydrogels die in de toekomst zijn voorbereid voor lever-op-een-chip-apparaten.
Op deze manier, de studie beschreef de voordelen van het gebruik van op hyaluronan-PEG gebaseerde hydrogel gemodificeerd met RGD-peptiden voor 3D-culturen van hepatocyten (ongeveer 13 dagen) in een lever-op-een-chip-opstelling. Als maatstaf voor het onderzoek, Christofferfsson en collega's gebruikten de algemeen beschikbare alginaat- en agarosehydrogels. In de toekomst, de wetenschappers zullen de visco-elastische eigenschappen en de concentratie van celadhesiemotieven op het HA-PEG-hydrogelsysteem optimaliseren voor biomimetische cytocompatibiliteit. The optimized hydrogel system can be combined with the device setup to facilitate physiologically relevant liver-on-a-chip platforms for clinical research in drug toxicology, drug discovery and regenerative medicine.
© 2019 Wetenschap X Netwerk
 Een manier om kunstmatige intelligentie te gebruiken om chemische reacties te voorspellen
Een manier om kunstmatige intelligentie te gebruiken om chemische reacties te voorspellen Materialen gebruikt voor tandwielen en katrollen
Materialen gebruikt voor tandwielen en katrollen  Easy Home Experiments met behulp van gaswetten
Easy Home Experiments met behulp van gaswetten Team ontwikkelt nieuwe methode om hernieuwbaar acrylonitril te produceren
Team ontwikkelt nieuwe methode om hernieuwbaar acrylonitril te produceren Kleine titanium barrière stopt groot probleem in brandstofproducerende zonnecellen
Kleine titanium barrière stopt groot probleem in brandstofproducerende zonnecellen
 Bergwolken - van regenmakers tot sneeuwmakers
Bergwolken - van regenmakers tot sneeuwmakers NASA ziet tyfoon Doksuri in de Zuid-Chinese Zee
NASA ziet tyfoon Doksuri in de Zuid-Chinese Zee Milieuvoorschriften zorgden voor een scherpe daling van de vervuiling door fabrieken in de VS
Milieuvoorschriften zorgden voor een scherpe daling van de vervuiling door fabrieken in de VS Cyprus nodigt biedingen uit om offshore gas te onderzoeken
Cyprus nodigt biedingen uit om offshore gas te onderzoeken Hoe zich te ontdoen van Groundhogs, mollen en Gophers
Hoe zich te ontdoen van Groundhogs, mollen en Gophers
Hoofdlijnen
- Genoomanalyse van vroege plantenafstamming werpt licht op hoe planten leerden te gedijen op het land
- Wat zijn de meest voorkomende oorzaken van uitsterven?
- Waar komt collageen vandaan?
- Bron van Beperking Enzymes
- Disruptieve bio-engineering - verandert de manier waarop cellen met elkaar omgaan
- Een klassieke darwinistische ecologische hypothese houdt stand - met een twist
- Kan graszaad net zo goed groeien op een lavasteen als op aarde?
- Gregor Mendel - Vader van genetica: biografie, experimenten en feiten
- Wat zijn endorfines?
- Een materiaal dat kneuzingen als een huid
- Wetenschappers vinden lichtgewicht vloeibare metalen materialen uit

- Films ontwikkelen met instelbare rek en breuk voor verschillende toepassingen
- Chemici ontwikkelen een eenvoudige, gebruiksvriendelijke methode om verontreinigende stoffen in water af te breken

- Wat is een gehydrateerd zout?

 Facebook vroeg gebruikers of pedofielen kinderen om seksuele foto's moesten kunnen vragen
Facebook vroeg gebruikers of pedofielen kinderen om seksuele foto's moesten kunnen vragen Twee factoren die invloed hebben op de zwaartekracht van een object
Twee factoren die invloed hebben op de zwaartekracht van een object  Nanodeeltje blokkeert sleutelmolecuul dat betrokken is bij de verspreiding van borstkanker
Nanodeeltje blokkeert sleutelmolecuul dat betrokken is bij de verspreiding van borstkanker Een vergelijking van staalbalken en Microlam balken
Een vergelijking van staalbalken en Microlam balken Waarom is de VAE, waar zonne-energie overvloedig aanwezig is, op het punt om vier kernreactoren te openen?
Waarom is de VAE, waar zonne-energie overvloedig aanwezig is, op het punt om vier kernreactoren te openen? Wat hoopten we te leren van de magnetische metingen van de laatste banen van Cassinis?
Wat hoopten we te leren van de magnetische metingen van de laatste banen van Cassinis? Het verkrijgen van distributie in kleine winkelformules levert grote winsten op, zelfs voor grote merken
Het verkrijgen van distributie in kleine winkelformules levert grote winsten op, zelfs voor grote merken Miljoenen nodig om Europa's Mars-missie voort te zetten:ESA-chef
Miljoenen nodig om Europa's Mars-missie voort te zetten:ESA-chef
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Spanish | Norway |

-
Wetenschap © https://nl.scienceaq.com

