
Wetenschap
Waarom kan ammoniumcarbonaat worden gebruikt om zowel zure als alkalische oplossingen te identificeren?
* ammoniumcarbonaat is een basiszout. Het hydrolyseert in water, produceert ammoniumionen (NH₄⁺) en carbonaationen (co₃²⁻). De carbonaationen reageren met water om bicarbonaationen (HCO₃⁻) en hydroxide -ionen (OH⁻) te vormen, waardoor de oplossing basisch wordt.
* Basisoplossingen worden rood likmus papier blauw. Dit is een standaardtest voor alkaliteit. Ammoniumcarbonaat, basisch, zou rood lakmoespapier blauw worden.
* Zure oplossingen worden blauw lakmus papier rood. Ammoniumcarbonaat, basisch, zou geen blauw lakmoespapier rood worden.
Samenvattend: Ammoniumcarbonaat zelf is eenvoudig en kan daarom niet worden gebruikt om zure oplossingen te identificeren. Het is alleen handig voor het identificeren van alkalische oplossingen door rood lakmoespapier blauw te worden.
Andere methoden om zuren en basen te identificeren:
* PH -papier: Dit artikel verandert van kleur, afhankelijk van de pH van de oplossing, waardoor een preciezere meting van de zuurgraad of alkaliteit biedt.
* indicatoren: Er bestaan veel andere chemische indicatoren, elk met een specifiek kleurveranderingsbereik voor verschillende pH -waarden.
* titratie: Een kwantitatieve methode om de concentratie van een onbekende zuur of base te bepalen door deze te reageren met een oplossing van bekende concentratie.
 Wetenschappers ontwikkelen nieuw systeem om opkomende door teken overgedragen ziekten te bestuderen
Wetenschappers ontwikkelen nieuw systeem om opkomende door teken overgedragen ziekten te bestuderen Eenvoudige chemie zal de duurzaamheid van betonproductie verbeteren
Eenvoudige chemie zal de duurzaamheid van betonproductie verbeteren Hoeveel mol Co² geproduceerd door de reactie 2.0 ch⁴ met overtollige o²?
Hoeveel mol Co² geproduceerd door de reactie 2.0 ch⁴ met overtollige o²?  De voordelen van potentiometrische titratie
De voordelen van potentiometrische titratie  Welke chemische stof kan worden gebruikt om ijzer te laten smelten?
Welke chemische stof kan worden gebruikt om ijzer te laten smelten?
 Vuur heroverwegen met data-analyse en systeemontwerp
Vuur heroverwegen met data-analyse en systeemontwerp Dwarsdoorsnede van de atmosfeer van de aarde
Dwarsdoorsnede van de atmosfeer van de aarde Zitten er antibiotica in drinkwater?
Zitten er antibiotica in drinkwater?  NASA ontdekt dat tropische cycloon Keni zware regen heeft laten vallen op Fiji, directe treffer naar Kadavu
NASA ontdekt dat tropische cycloon Keni zware regen heeft laten vallen op Fiji, directe treffer naar Kadavu Great Barrier Reef lijdt aan massale verbleking van koraal
Great Barrier Reef lijdt aan massale verbleking van koraal
Hoofdlijnen
- Een fragment van een streng nucleïnezuur geïsoleerd uit zijden mottensoorten bevat de basissertequentie die het moet zijn?
- Nieuwe aanwijzingen over hoe poortwachter voor de celkern werkt
- Hoe één gen in een kleine vis een aquatisch ecosysteem kan veranderen
- Wat is een psyllidvector?
- Welk medicijn bevat planten?
- Hoe te lezen Proteïne elektroforese
- Wat is de een gevolgtrekking?
- Chemici ontdekken hoe cellen stabiliteit creëren tijdens cruciale DNA-naar-RNA-informatieoverdracht
- Wat is de naam van grote centrale organel in eukaryotische cellen die chromosomen bevat?
- Moleculaire energiemachine als filmster

- Totale synthese van flueggenine C via een versnelde intermoleculaire Rauhut-Currier-reactie
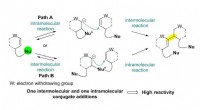
- 3D-printen van hiërarchische structuren van vloeibaar kristal-polymeer
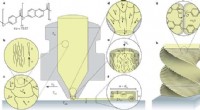
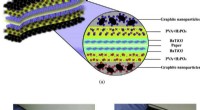
- De vorm van de dingen die komen gaan:flexibel, opvouwbare supercondensatoren voor energieopslag
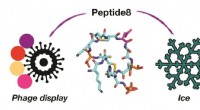
- Fagen gebruiken om nieuwe antivries-eiwitten te ontdekken
 Wat zijn de namen van 48 vulkanen in Auckland?
Wat zijn de namen van 48 vulkanen in Auckland?  Kunstmatige huid zweet op commando
Kunstmatige huid zweet op commando Strategieën voor milieuvriendelijke en duurzame polyamideproductie
Strategieën voor milieuvriendelijke en duurzame polyamideproductie  Waarom is intelligentie bewijs van evolutie?
Waarom is intelligentie bewijs van evolutie?  Uit onderzoek blijkt hoe de bossen in het oosten van de VS zijn ontstaan
Uit onderzoek blijkt hoe de bossen in het oosten van de VS zijn ontstaan  Welk gas ontstaat wanneer zoutzuur en magnesium worden gemengd?
Welk gas ontstaat wanneer zoutzuur en magnesium worden gemengd?  Welke term wordt gedefinieerd als een gedrag of eigenschap van een organisme waardoor het in zijn specifieke omgeving kan overleven?
Welke term wordt gedefinieerd als een gedrag of eigenschap van een organisme waardoor het in zijn specifieke omgeving kan overleven?  Onderzoek toont aan dat Pinterest een anti-vaccinatiebias heeft
Onderzoek toont aan dat Pinterest een anti-vaccinatiebias heeft
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

