
Wetenschap
Waarom hebben calciumoxide en natriumchloride verschillende smeltpunten?
1. Bondtype:
* calciumoxide (Cao): Cao is een ionische verbinding met een sterke ionische binding tussen het calciumkation (ca²⁺) en de oxide -anion (o²⁻). Deze ionische bindingen zijn zeer sterk vanwege de elektrostatische aantrekkingskracht tussen de tegengesteld geladen ionen.
* Natriumchloride (NaCl): NaCl is ook een ionische verbinding met een sterke ionische binding tussen het natriumkation (Na⁺) en het chloride -anion (CL⁻).
2. Roosterergie:
* calciumoxide (Cao): Cao heeft een hogere roosterergie dan NaCl. Dit betekent dat de elektrostatische aantrekkingskracht tussen de ionen in CAO sterker is. Dit komt omdat:
* opladen: Calciumionen (ca²⁺) hebben een +2 lading, terwijl natriumionen (Na⁺) een +1 lading hebben. Oxide -ionen (o²⁻) hebben een -2 lading, terwijl chloride -ionen (CL⁻) een -1 lading hebben. Hoe groter de ladingen, hoe sterker de elektrostatische aantrekkingskracht.
* Grootte: Calciumionen zijn kleiner dan natriumionen. Oxide -ionen zijn ook kleiner dan chloride -ionen. Kleinere ionen pakken dichter bij elkaar, waardoor de sterkte van de elektrostatische aantrekkingskracht wordt vergroot.
3. Smeltpunt:
* hoger smeltpunt van Cao: De sterkere ionische bindingen en hogere roosterergie in CAO vereisen meer energie om de elektrostatische aantrekkingskracht te overwinnen en het ionische rooster te breken, wat leidt tot een hoger smeltpunt.
Samenvattend:
Het hogere smeltpunt van calciumoxide vergeleken met natriumchloride wordt voornamelijk toegeschreven aan de sterkere elektrostatische attracties tussen zijn ionen vanwege hun hogere ladingen en kleinere maten.
 Hoe worden elementen genoemd als ze in de natuur voorkomen?
Hoe worden elementen genoemd als ze in de natuur voorkomen?  Ongeveer de helft van de hydraulisch gebroken putten bevindt zich binnen 2 tot 3 kilometer van huishoudelijke grondwatersystemen:studie
Ongeveer de helft van de hydraulisch gebroken putten bevindt zich binnen 2 tot 3 kilometer van huishoudelijke grondwatersystemen:studie Hoe bloemen geur en nectar gebruiken om bestuivers en herbivoren te manipuleren
Hoe bloemen geur en nectar gebruiken om bestuivers en herbivoren te manipuleren  Waarom het zuiden van de VS vatbaar is voor tornado's in december
Waarom het zuiden van de VS vatbaar is voor tornado's in december Welk dier doodt de meeste mensen? Hier is een onverwacht roofdier en hoe je jezelf kunt beschermen
Welk dier doodt de meeste mensen? Hier is een onverwacht roofdier en hoe je jezelf kunt beschermen
Hoofdlijnen
- Welk orgel pompt zuurstof en voedingsstoffen naar de weefsels van het lichaam?
- Bloem trekt insecten aan door zich voor te doen als paddenstoel
- Wat is kort voor fotosynthese?
- Wat zijn de vier factoren die enzymactiviteit beïnvloeden?
- Het mRNA-molecuul wordt voltooid door de vorming van wat tussen rna?
- Waar is het lichaam het meest uit samengesteld?
- Wat zijn de functies van eiwitten in het lichaam?
- Onderzoek verklaart waarom hennep en marihuana verschillend zijn
- Wat is de functie van het tissue van het collenchym?
- Chemicus stelt nieuwe manier voor om de brandstofkwaliteit te verbeteren met behulp van microgolfstraling
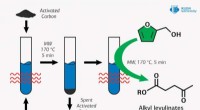
- Uraniumchemie en geologische berging van radioactief afval

- Nobelprijswinnende Japanse chemicus sterft op 85

- Onderzoekers maken leerachtig materiaal van zijde-eiwitten

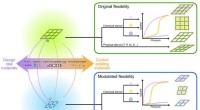
- Op weg naar het ontwerpen/beheersen van flexibiliteit van MOF's
 Onderzoekers onderzoeken moleculaire gasemissie van het sterrenstelsel NGC 3557
Onderzoekers onderzoeken moleculaire gasemissie van het sterrenstelsel NGC 3557 Tropische gewassen kunnen eronder lijden omdat klimaatverandering langere droge perioden met zich meebrengt
Tropische gewassen kunnen eronder lijden omdat klimaatverandering langere droge perioden met zich meebrengt Een computationele snelkoppeling voor neurale netwerken
Een computationele snelkoppeling voor neurale netwerken De gevolgen van Tornado's voor de mens en de natuur
De gevolgen van Tornado's voor de mens en de natuur Hoe lang bestaan de sterren in uw zonnestelsel?
Hoe lang bestaan de sterren in uw zonnestelsel?  Wat zijn de oudste lichamen in het zonnestelsel?
Wat zijn de oudste lichamen in het zonnestelsel?  Wat is het doel van eenvoudige destillatie?
Wat is het doel van eenvoudige destillatie?  Wat is de naam van het proces dat eindproduct ATP?
Wat is de naam van het proces dat eindproduct ATP?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

