
Wetenschap
Hoe neerstrijkt waterige ammoniumsulfaat -eiwitten?
1. Hydrofobe interacties:
* Eiwitten zijn typisch oplosbaar in water vanwege hun hydrofiele (waterminnende) groepen, die waterstofbruggen vormen met watermoleculen.
* Ze bevatten echter ook hydrofobe (waterfense) groepen die de neiging hebben om samen te clusteren.
2. De invloed van ammoniumsulfaat:
* Wanneer ammoniumsulfaat wordt toegevoegd aan een eiwitoplossing, interageert het met de watermoleculen, waardoor ze effectief worden weggelaten van de hydrofiele groepen van het eiwit.
* Deze verstoring van hydratatieschalen rond het eiwit legt de hydrofobe groepen bloot.
3. Aggregatie en neerslag:
* Naarmate de concentratie van ammoniumsulfaat toeneemt, worden de hydrofobe groepen op verschillende eiwitmoleculen meer blootgesteld en interageren met elkaar, wat leidt tot aggregatie.
* Uiteindelijk worden deze aggregaten groot genoeg om onoplosbaar te worden en neer te slaan uit oplossing.
Factoren die de neerslag beïnvloeden:
* eiwitconcentratie: Hogere eiwitconcentraties vereisen hogere ammoniumsulfaatconcentraties voor neerslag.
* Eiwittype: Verschillende eiwitten hebben verschillende mate van hydrofobiciteit, wat leidt tot verschillende gevoeligheden voor ammoniumsulfaatprecipitatie.
* pH: De pH van de oplossing kan de lading van het eiwit en de interactie ervan met ammoniumsulfaat beïnvloeden.
* Temperatuur: Hogere temperaturen verbeteren in het algemeen de oplosbaarheid van eiwitten, waardoor hogere ammoniumsulfaatconcentraties voor neerslag vereisen.
Toepassingen van ammoniumsulfaatprecipitatie:
* Eiwitzuivering: Het is een veel voorkomende techniek voor het concentreren en gedeeltelijk zuiveren van eiwitten uit complexe mengsels.
* kristallisatie: Ammoniumsulfaat kan worden gebruikt om eiwitkristallisatie te bevorderen, wat cruciaal is voor structurele studies.
Voordelen van het gebruik van ammoniumsulfaat:
* Relatief goedkoop en direct beschikbaar.
* Over het algemeen niet-ontkenning van eiwitten, wat betekent dat het hun natieve structuur niet vernietigt.
* Maakt selectieve neerslag mogelijk op basis van eiwiteigenschappen.
Overwegingen:
* Het is cruciaal om de ammoniumsulfaatconcentratie voor elk specifiek eiwit en de gewenste uitkomst te optimaliseren.
* Het neerslag kan andere moleculen bevatten naast het doel -eiwit, waardoor verdere zuiveringsstappen nodig zijn.
* Sommige eiwitten kunnen gevoelig zijn voor hoge zoutconcentraties.
Conclusie is ammoniumsulfaatprecipitatie een waardevolle techniek voor het scheiden en zuiveren van eiwitten door de verschillen in hun hydrofobe interacties en oplosbaarheid in aanwezigheid van hoge zoutconcentraties te benutten. .
 Welke stoffen kunnen worden gescheiden door vacuümdestillatie?
Welke stoffen kunnen worden gescheiden door vacuümdestillatie?  Wordt er een niet-polaire binding gevormd wanneer twee atomen elektronen ongelijk delen?
Wordt er een niet-polaire binding gevormd wanneer twee atomen elektronen ongelijk delen?  Lipoproteïnen gedragen zich bijna als een kleine klittenbandbal
Lipoproteïnen gedragen zich bijna als een kleine klittenbandbal Welk element uit periode 5 heeft valentie-elektronen?
Welk element uit periode 5 heeft valentie-elektronen?  Hoe zijn fossiele brandstoffen en zure neerslagrelatie gerelateerd?
Hoe zijn fossiele brandstoffen en zure neerslagrelatie gerelateerd?
 Chinese rivieren en meren zwellen gevaarlijk op naarmate het zomerseizoen overstroomt
Chinese rivieren en meren zwellen gevaarlijk op naarmate het zomerseizoen overstroomt Het kennen van uw buren kan de zorgpraktijken van het Amerikaanse huishouden bepalen
Het kennen van uw buren kan de zorgpraktijken van het Amerikaanse huishouden bepalen Antarctica toerisme verordening dringend voor het milieu:top
Antarctica toerisme verordening dringend voor het milieu:top Opinie:Maatregelen van armoede en welzijn negeren nog steeds het milieu – dit moet veranderen
Opinie:Maatregelen van armoede en welzijn negeren nog steeds het milieu – dit moet veranderen Het drie minuten durende verhaal van 800, 000 jaar klimaatverandering met een steek in de staart
Het drie minuten durende verhaal van 800, 000 jaar klimaatverandering met een steek in de staart
Hoofdlijnen
- Wat is de rol van bacteriën met stikstofbevestiging?
- Kan glucose door het celmembraan diffunderen door eenvoudige diffusie?
- Stamcelvaccins: de nieuwe grens in kanker-therapie?
- Waarom cellen schakelen van aerobe naar anaërobe tijdens een race?
- Wat is de wetenschappelijke naam voor stalagmieten?
- Wat is Mean Tby een sterke sleutel in de wetenschap?
- Waarom gaan leerlingen met een handicap naar 'speciale scholen' als onderzoek ons leert dat ze beter kunnen presteren in het reguliere systeem?
- Wat zijn grafologische kenmerken?
- Waar komen de gameten vandaan in de levenscyclus van een plant?
- Wetenschappers ontwikkelen zeer gevoelige moleculaire optische druksensor

- Het proteoom van de zoete aardappel opgraven
- Nieuwe slimme sensor kan een revolutie teweegbrengen in de preventie van misdaad en terrorisme

- Wateroppervlaktemoleculen verliezen energie door rotatie van vrije OH-groep
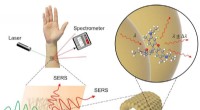
- Een nieuwe Raman chemische sensor gemaakt van noedelachtige draden van goud
 Chemici vergroten het nut van boor:voorkomen dat verbindingen worden afgebroken, kan scheikundigen helpen bij het ontwerpen van nieuwe medicijnen
Chemici vergroten het nut van boor:voorkomen dat verbindingen worden afgebroken, kan scheikundigen helpen bij het ontwerpen van nieuwe medicijnen Doorbraak in microfabricage kan piëzo-elektrische materiaaltoepassingen in gang zetten
Doorbraak in microfabricage kan piëzo-elektrische materiaaltoepassingen in gang zetten Chemici spreken zich uit over seksuele intimidatie in de academische wereld
Chemici spreken zich uit over seksuele intimidatie in de academische wereld Meer dan 3000 jaar menselijke activiteit op 5 vierkante meter
Meer dan 3000 jaar menselijke activiteit op 5 vierkante meter Beschrijf manieren om erosie op steile hellingen te vertragen?
Beschrijf manieren om erosie op steile hellingen te vertragen?  Op slangen geïnspireerde robot glijdt nog beter dan zijn voorganger
Op slangen geïnspireerde robot glijdt nog beter dan zijn voorganger De Sneeuwmaan is de Volle Maan van februari
De Sneeuwmaan is de Volle Maan van februari  Onderzoekers karakteriseren muggengenen om te leren hoe insecten zich verdedigen tegen parasieten die malaria veroorzaken
Onderzoekers karakteriseren muggengenen om te leren hoe insecten zich verdedigen tegen parasieten die malaria veroorzaken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

