
Wetenschap
Waarom bestaat fluor als een diatomee molecuul?
* Hoge elektronegativiteit: Fluor is het meest elektronegatieve element op het periodiek systeem. Dit betekent dat het een sterke neiging heeft om elektronen aan te trekken.
* Kleine atoommaat: Fluor heeft een zeer kleine atoomradius, wat resulteert in een sterke overlapping van atomaire orbitalen wanneer twee fluoratomen dicht bij elkaar komen.
* Vorming van een sterke covalente binding: De sterke overlapping van atomaire orbitalen leidt tot de vorming van een zeer sterke covalente binding tussen twee fluoratomen. Deze band is zo sterk dat het moeilijk is om te breken, waardoor F₂ een stabiel molecuul is.
Hier is een meer gedetailleerde uitleg:
1. Elektronegativiteit: Fluor's hoge elektronegativiteit betekent dat het een elektron wil krijgen om een stabiele octetconfiguratie te bereiken. Een enkel fluoratoom kan dit echter niet alleen bereiken.
2. Diatomaire molecuulvorming: Door een covalente binding te vormen met een ander fluoratoom, kan elk atoom een elektron delen, zijn octet voltooien en stabiliteit bereiken. Dit delen van elektronen creëert een sterke covalente binding.
3. Bindingssterkte: De kleine omvang van fluoratomen zorgt voor een significante overlapping van hun atomaire orbitalen, wat leidt tot een zeer sterke covalente binding. Deze sterke binding draagt bij aan de stabiliteit van het F₂ -molecuul.
Samenvattend maakt de combinatie van de hoge elektronegativiteit van fluor, kleine atoomgrootte en de resulterende sterke covalente binding de diatomeeënvorm (F₂) de meest stabiele en voorkeursvorm van fluor.
 Nieuw membraan scheidt gespiegelde moleculen efficiënt
Nieuw membraan scheidt gespiegelde moleculen efficiënt Aluminiumrecyclingtechnologie gestimuleerd door kristallisatieonderzoek
Aluminiumrecyclingtechnologie gestimuleerd door kristallisatieonderzoek Wat is de lading van een cadmiumatoom met 48 elektronen?
Wat is de lading van een cadmiumatoom met 48 elektronen?  Het gebruik van schaaldieren bij het genezen van wonden - de toekomst van de geneeskunde?
Het gebruik van schaaldieren bij het genezen van wonden - de toekomst van de geneeskunde? Soorten microscopen & hoe ze worden gebruikt
Soorten microscopen & hoe ze worden gebruikt
 Wat is een bierbatterij?
Wat is een bierbatterij?  Stedelijke vorm en de huizencrisis:kunnen straten en gebouwen een wijk betaalbaarder maken?
Stedelijke vorm en de huizencrisis:kunnen straten en gebouwen een wijk betaalbaarder maken?  Twee doden, honderden vluchten voor overstromingen in Filippijnse storm
Twee doden, honderden vluchten voor overstromingen in Filippijnse storm Waarom ben jij, beste zoöplankton?
Waarom ben jij, beste zoöplankton?  Droogte in de Hoorn van Afrika:onderzoek toont aan hoe een netwerk van grondwaterboringen zou kunnen helpen
Droogte in de Hoorn van Afrika:onderzoek toont aan hoe een netwerk van grondwaterboringen zou kunnen helpen
Hoofdlijnen
- Welke moleculen je op je telefoon achterlaat, onthullen iets over je levensstijl
- Niet-vasculaire plant: definitie, kenmerken, voordelen en voorbeelden
- Waarom is stikstof belangrijk voor levende wezens?
- Niet-duurzame voedselsystemen:kunnen we de huidige trends omkeren?
- Welke kenmerken zijn tegenwoordig het belangrijkst voor het evolutionaire succes van het organisme op aarde?
- Wat moet een cel van eukaryote DNA vasthouden die prokaryote niet heeft?
- Team bepaalt hoe oestrogenen in zuivelafvalwater blijven bestaan
- Een Chromosome-diagram interpreteren
- Hoe planten vrienden worden met schimmels
- Strijkijzer uit printerafvaltoner trekken
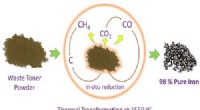
- Onderzoeker verandert vuil aluminiumfolie in katalysator voor biobrandstof

- Mega docking-bibliotheek klaar om de ontdekking van medicijnen te versnellen
- Opwindend nieuw materiaal maakt gebruik van zonne-energie om door de mens gemaakte kleurstofverontreinigende stoffen uit water te verwijderen

- Vloeistof heeft structuur, wat de sleutel kan zijn tot het begrijpen van metaalglas

 Wat is de naam voor protisten die hun eigen voedsel kunnen produceren?
Wat is de naam voor protisten die hun eigen voedsel kunnen produceren?  Reductie door reductie:nieuwe aanpak om chroomverontreiniging in afvalwater te verminderen
Reductie door reductie:nieuwe aanpak om chroomverontreiniging in afvalwater te verminderen De zonnewinden blazen naar buiten naar buiten?
De zonnewinden blazen naar buiten naar buiten?  Onderzoekers beschrijven hoe vorm te controleren, structuur van DNA en RNA
Onderzoekers beschrijven hoe vorm te controleren, structuur van DNA en RNA Zullen smartphone-apps de sociale media als back-to-school-shoppingtool uitroeien?
Zullen smartphone-apps de sociale media als back-to-school-shoppingtool uitroeien?  Luchtvervuiling recyclen om kunst te maken
Luchtvervuiling recyclen om kunst te maken Het maken van nepvlees roept vragen op over de gezondheid, ethiek en duurzaamheid voor een voormalige slager
Het maken van nepvlees roept vragen op over de gezondheid, ethiek en duurzaamheid voor een voormalige slager Een nieuw kunstmatig kwantummateriaal voor toekomstige computers met hoog rendement
Een nieuw kunstmatig kwantummateriaal voor toekomstige computers met hoog rendement
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

