
Wetenschap
Overgangsmetalen zoals koper of wolfraam vormen verbindingen door?
1. Ionische binding:
* Overgangsmetalen kunnen elektronen verliezen om positief geladen kationen te vormen. Deze kationen vormen vervolgens ionische bindingen met negatief geladen anionen.
* Voorbeeld: Cu²⁺ (koper (II) ion) vormt ionische bindingen met CL⁻ (chloride -ionen) om koper (II) chloride (CUCL₂) te creëren.
2. Covalente binding:
* Overgangsmetalen kunnen ook elektronen delen met andere atomen om covalente bindingen te vormen.
* Voorbeeld: Wolfraam vormt covalente bindingen met zuurstof in wolfraamoxide (WO₃).
3. Coördineren binding:
* Overgangsmetalen kunnen elektronenparen accepteren van liganden (moleculen of ionen die elektronen doneren). Dit vormt coördinaten bindingen, die een type covalente binding zijn.
* Voorbeeld: Koper (II) ionen vormen coördinatenbindingen met watermoleculen om het gehydrateerde koper (II) ion [Cu (H₂o) ₄] ²⁺ te vormen.
4. Metallic binding:
* Overgangsmetalen kunnen metaalbindingen vormen met andere metaalatomen. Dit omvat de delocalisatie van elektronen over een rooster van metaalatomen.
* Voorbeeld: Pure Tungsten vertoont metalen binding.
5. Complexe vorming:
* Overgangsmetalen kunnen coördinatiecomplexen vormen, waarbij het metaalion wordt omgeven door een groep liganden. Deze complexen vertonen vaak unieke eigenschappen en kleuren.
* Voorbeeld: De complexe ion [Fe (CN) ₆] ⁴⁻ (ferrocyanide) is een coördinatiecomplex met een centraal ijzerion omgeven door zes cyanide -liganden.
factoren die binding beïnvloeden:
* Oxidatietoestand: De oxidatietoestand van het overgangsmetaal kan het type binding -vormen beïnvloeden.
* Ligand Type: De aard van de liganden (bijvoorbeeld hun elektronegativiteit, grootte) kan ook de binding beïnvloeden.
* Elektronische configuratie: De elektronische configuratie van het overgangsmetaal speelt een rol bij het bepalen van de reactiviteit en het vermogen om verschillende soorten bindingen te vormen.
Concluderend vormen overgangsmetalen verbindingen door een combinatie van ionische, covalente, coördinaten- en metaalbindingsmechanismen, wat vaak leidt tot de vorming van complexe en kleurrijke verbindingen.
 Satellieten analyseren het ontwikkelende golfpotentieel Tropische cycloon twee
Satellieten analyseren het ontwikkelende golfpotentieel Tropische cycloon twee Microben kunnen de poortwachters zijn van de grootste broeikasgasreserves van de planeet
Microben kunnen de poortwachters zijn van de grootste broeikasgasreserves van de planeet Dakota pijpleidingbedrijf klaagt milieugroeperingen aan
Dakota pijpleidingbedrijf klaagt milieugroeperingen aan Wat zijn de voor- en nadelen van klimaatverandering?
Wat zijn de voor- en nadelen van klimaatverandering?  Does It Rain in a Desert?
Does It Rain in a Desert?
Hoofdlijnen
- Nieuwe drievoudige medicijncombinatie effectief tegen antibioticaresistente bacteriën
- Een beetje stress is goed voor de gezondheid van de cellen en een lang leven
- Hebben sommige eencellige organismen speciale structuren om overtollig water te pompen?
- De opkomst van vissen verlicht door ontdekking van fossielenschat
- Studie onthult hoe de adelborst zijn paar uur lang in stand houdt
- Onderzoekers tonen nieuwe techniek die DNA kan 'proeven'
- Meer dan 38 procent van de Neotropische papegaaienpopulatie op het Amerikaanse continent wordt bedreigd door menselijke activiteit
- Wat is een prehistorische toolkit en hoe zou het de menselijke geschiedenis kunnen herschrijven?
- Wat is het lot van buiskern in pollenbuis?
- Biosensorverband verzamelt en analyseert zweet
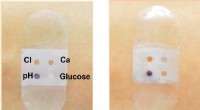
- Een manier bedenken om microplastics uit afvalwater te verwijderen - met okra, aloë

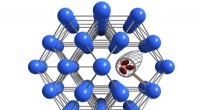
- Defecten in nanoporeuze materialen temmen om ze nuttig te gebruiken
- Een keramische resurfacing prothese voor heupgewrichten

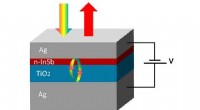
- Onderzoekers komen op de golflengte van de consument met InSb-technologie
 Narcisten zullen minder geneigd zijn om democratie te steunen
Narcisten zullen minder geneigd zijn om democratie te steunen De gezondheidsvoordelen van biologisch voedsel zijn moeilijk te beoordelen, maar dat kan veranderen
De gezondheidsvoordelen van biologisch voedsel zijn moeilijk te beoordelen, maar dat kan veranderen Welk type magma veroorzaakt rustige vulkanen?
Welk type magma veroorzaakt rustige vulkanen?  Herstarten van de coronavirus economie:4 mogelijke stappen
Herstarten van de coronavirus economie:4 mogelijke stappen Het vullen van de grootste dam van Afrika brengt politieke spanningen met zich mee als de technische realiteit wordt genegeerd
Het vullen van de grootste dam van Afrika brengt politieke spanningen met zich mee als de technische realiteit wordt genegeerd Hoe fluorescerende nanodeeltjes te produceren voor medische toepassingen in een kernreactor
Hoe fluorescerende nanodeeltjes te produceren voor medische toepassingen in een kernreactor  Gehandicaptencategorieën in het onderwijs werden opnieuw gedefinieerd om minderheden uit te sluiten, studie toont
Gehandicaptencategorieën in het onderwijs werden opnieuw gedefinieerd om minderheden uit te sluiten, studie toont Kinderen zonder computers worden achtergelaten met scholen gesloten door het coronavirus
Kinderen zonder computers worden achtergelaten met scholen gesloten door het coronavirus
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

