
Wetenschap
Hoe lijken twee isotopen van een element op elkaar?
1. Hetzelfde atoomnummer :Isotopen van hetzelfde element hebben hetzelfde aantal protonen in hun atoomkernen. Dit betekent dat ze hetzelfde atoomnummer delen, wat het element op unieke wijze identificeert. Alle isotopen van koolstof hebben bijvoorbeeld zes protonen.
2. Chemische eigenschappen :Isotopen van een element vertonen over het algemeen zeer vergelijkbare chemische eigenschappen. Ze reageren op dezelfde manier en vormen dezelfde soorten verbindingen, omdat het chemische gedrag van een element voornamelijk wordt bepaald door het aantal elektronen in de buitenste schil, dat voor verschillende isotopen hetzelfde blijft.
3. Vergelijkbare elektronische configuraties :Afgezien van het verschil in het aantal neutronen, hebben isotopen van een element dezelfde rangschikking van elektronen in hun energieniveaus. Deze vergelijkbare elektronische configuratie leidt tot vergelijkbare atomaire en moleculaire structuren, wat resulteert in vergelijkbaar algemeen chemisch gedrag.
4. Dezelfde positie in het periodiek systeem :Isotopen bezetten dezelfde positie in het periodiek systeem omdat ze hetzelfde atoomnummer hebben. Daarom delen ze vergelijkbare algemene eigenschappen die verband houden met hun positie in het periodiek systeem, zoals de groep (kolom) en periode (rij) waartoe ze behoren.
5. Spectroscopische eigenschappen :De spectra van isotopen vertonen vaak zeer kleine verschillen, vooral bij nauwkeurige metingen. Deze discrepanties ontstaan als gevolg van de enigszins verschillende massa's van isotopen, die hun trillings- en rotatie-energieën beïnvloeden. Spectroscopische technieken kunnen worden gebruikt om onderscheid te maken tussen isotopen op basis van deze subtiele spectrale variaties.
Over het algemeen delen isotopen van een element verschillende fundamentele kenmerken, waaronder hetzelfde atoomnummer, identieke chemische eigenschappen, vergelijkbare elektronische configuraties en dezelfde positie in het periodiek systeem. Ze kunnen echter enigszins verschillen in bepaalde fysieke eigenschappen, zoals het aantal neutronen en het resulterende massaverschil.
 Wetenschappers ontdekken dat watermicrodruppels kunnen veranderen in waterstofperoxide wanneer ze condenseren op koude oppervlakken
Wetenschappers ontdekken dat watermicrodruppels kunnen veranderen in waterstofperoxide wanneer ze condenseren op koude oppervlakken Hoe een container te bouwen waar het ijs gedurende 4 uur niet smelt
Hoe een container te bouwen waar het ijs gedurende 4 uur niet smelt Hoeveel protonen heeft cesium?
Hoeveel protonen heeft cesium?  Is ethylalcohol een ionische of covalente binding?
Is ethylalcohol een ionische of covalente binding?  Voorbeelden van Alkynes
Voorbeelden van Alkynes
 Satelliet volgt post-tropische cycloon Harvey die zich verspreidt naar Ohio Valley
Satelliet volgt post-tropische cycloon Harvey die zich verspreidt naar Ohio Valley Gletsjerdetachementen:een nieuw gevaar in een opwarmende wereld?
Gletsjerdetachementen:een nieuw gevaar in een opwarmende wereld? Onderzoekers gebruiken drones om waterstromen in de grond te monitoren
Onderzoekers gebruiken drones om waterstromen in de grond te monitoren NASA volgt een zwakkere kommavormige tropische cycloon Marcus
NASA volgt een zwakkere kommavormige tropische cycloon Marcus Pixels naar weiland:hoe AI boeren kan helpen hun weiland te voorspellen
Pixels naar weiland:hoe AI boeren kan helpen hun weiland te voorspellen
Hoofdlijnen
- Genetische drift, en niet natuurlijke selectie, geïdentificeerd als de belangrijkste factor die soortvorming bij bedreigde soorten pupfish aanstuurt
- Een driedimensionaal tandmodel maken voor een schoolproject
- Hoe kan een op coöperatieve organisaties gebaseerde organisatie van de inheemse visserij de afnemende veerkracht van bestanden bevorderen?
- Is het kennen van je volledige genoom een recht of een voorrecht?
- VS meldt het tweede menselijke geval van vogelgriep dat verband houdt met de uitbraak van melkkoeien
- Onderzoekers vinden dat de voorouder van algen de sleutel is tot de verspreiding van dodelijke ziekteverwekkers
- Bij transport bij zoogdieren gaat het doorgaans om absorptie en absorptie.
- Wetenschappers ontdekken hoe cellen reageren op vasten
- Voorbeelden van archaebacteriën met hun wetenschappelijke naam en classificatie
- Een nieuwe methode voor de productie van geprotoneerde waterstof

- Monitoring van de corrosie van bioresorbeerbaar magnesium

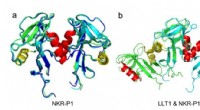
- Van atoom tot natural killer cel:het verhaal van een onverwachte eiwitstructuur
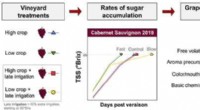
- Het vertragen van de rijping van druiven kan de kwaliteit van de bessen voor het maken van wijn verbeteren
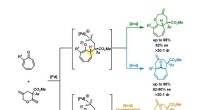
- Uiteenlopende synthese van bicyclische middelgrote ringstructuren
 Wat gebeurt er tijdens fase een van fotosynthese?
Wat gebeurt er tijdens fase een van fotosynthese?  Neerslagmetingen in heel Duitsland via het mobiele netwerk
Neerslagmetingen in heel Duitsland via het mobiele netwerk Het verlangen naar informatie:Zalige onwetendheid of pijnlijke waarheid?
Het verlangen naar informatie:Zalige onwetendheid of pijnlijke waarheid? Evaluatie van nieuwe verwerkingsplatforms voor farmaceutische productie
Evaluatie van nieuwe verwerkingsplatforms voor farmaceutische productie Onderzoeken waarom jonge vrouwen in Australië terughoudend zijn om de politiek in te gaan
Onderzoeken waarom jonge vrouwen in Australië terughoudend zijn om de politiek in te gaan  Onderzoeksteam combineert twee katalysatoren om de gemeenschappelijke chemische productie veiliger en milieuvriendelijker te maken
Onderzoeksteam combineert twee katalysatoren om de gemeenschappelijke chemische productie veiliger en milieuvriendelijker te maken  TESS-missie om nieuwe planeten te ontdekken gaat richting lancering
TESS-missie om nieuwe planeten te ontdekken gaat richting lancering Studie vergelijkt Salmonella-percentages in monsters van commerciële pluimveehouderijen in de achtertuin
Studie vergelijkt Salmonella-percentages in monsters van commerciële pluimveehouderijen in de achtertuin
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

