
Wetenschap
Waarom zijn atomen van metalen en niet -reactief?
* Metallic binding: Metalen hebben een unieke bindingsstructuur waarbij hun buitenste elektronen losjes gebonden zijn aan de atomen. Deze elektronen vormen een "zee" van gedelokaliseerde elektronen die gemakkelijk door het metaal kunnen bewegen.
* elektropositiviteit: Metalen hebben de neiging om lage ionisatie -energieën te hebben, wat betekent dat ze elektronen gemakkelijk verliezen om positieve ionen (kationen) te vormen.
* Reactiviteit: Deze combinatie van factoren maakt metalen zeer reactief. Ze hebben de neiging om gemakkelijk te reageren met andere elementen om een stabiele elektronenconfiguratie te bereiken door elektronen te verliezen.
Hier is een uitsplitsing waarom metalen reactief zijn:
* reactie met zuurstof: Veel metalen reageren met zuurstof om oxiden te vormen. IJzer reageert bijvoorbeeld met zuurstof om ijzeroxide (roest) te vormen.
* reactie met zuren: Metalen reageren met zuren om waterstofgas en een zout te produceren. Zink reageert bijvoorbeeld met zoutzuur om zinkchloride en waterstofgas te produceren.
* reactie met water: Sommige metalen reageren met water om metaalhydroxiden en waterstofgas te vormen. Natrium reageert bijvoorbeeld krachtig met water.
Opmerking: Er zijn enkele uitzonderingen op deze algemene trend. Sommige metalen, zoals goud en platina, zijn relatief niet -reactief vanwege hun hoge ionisatie -energieën en stabiele elektronenconfiguraties.
Samenvattend zijn metalen over het algemeen reactief vanwege hun metalen binding en de neiging om elektronen te verliezen.
Hoofdlijnen
- De oranje vleugels en het DNA van de kroontjeswants:hoe de diëten van insecten worden onthuld door het genoom
- Wat zijn de drie soorten skeletkraakbeen?
- Kan Nieuw-Zeeland de nationale beschermingsinspanningen ter bestrijding van plaagzoogdieren coördineren?
- Wat gebeurt er als er geen zuurstof beschikbaar is aan het einde van langzame glycolyse?
- Wat is een Golgi-apparaat?
- Welke manier stroomt de genetische informatie?
- Waarom Microscope nodig in de studie van zolaogie?
- Wat betekent de term RNP in de biologie?
- Heeft vruchtbaarheid invloed op de lichaamsgeur van een vrouw? Studie vindt geen bewijs
- Hoge thermo-elektrische prestaties in goedkope SnS0.91Se0.09-kristallen
- Een supersnel proces voor machinale bewerking op nanoschaal

- Enzym ontdekt in de darm kan leiden tot nieuwe biomarker voor ziekten
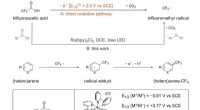
- Trifluorazijnzuur werkt als trifluormethyleringsmiddel bij de functionalisering van areen C-H
- Wetenschappers ontwikkelen nieuwe verbinding die beide soorten antibioticaresistente superbacteriën doodt
 De definitie van abiotische en biotische factoren
De definitie van abiotische en biotische factoren Hubble bekijkt een interactieve spiraal
Hubble bekijkt een interactieve spiraal De stress en spanningen van werk en werkloosheid
De stress en spanningen van werk en werkloosheid Welke metalen zijn het zwaarst?
Welke metalen zijn het zwaarst?  Afbeelding:Sluier van ijs in de ringen van Saturnus
Afbeelding:Sluier van ijs in de ringen van Saturnus Glitter van zilver verlicht de duistere geheimen van Alzheimer
Glitter van zilver verlicht de duistere geheimen van Alzheimer Melkgif van de dodelijke zeedieren in Australië
Melkgif van de dodelijke zeedieren in Australië  Leg uit Hoe zou u de volgende mengsels scheiden, kunnen stroomdiagram A NH4CL gebruiken van SiO2 B en I2?
Leg uit Hoe zou u de volgende mengsels scheiden, kunnen stroomdiagram A NH4CL gebruiken van SiO2 B en I2?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


