
Wetenschap
Hook-on drugs:nieuwe leveringsstrategie voor verstoring van K-Ras

Dr. Ohkanda heeft de verbinding strategisch ontworpen om in het gat van het enzym te haken. Krediet:Junko Ohkanda Ph.D., Hoogleraar Academische Vergadering, Instituut voor Landbouw, Shinshu-universiteit
"De strategie was om het medicijn te ontwerpen om in het gat van de FTase en GGTase I te kunnen haken, anders is het oppervlak van de eiwitten te groot en te glad, " Dr. Junko Ohkanda van Shinshu University legt haar strategie uit achter haar paper gekozen door Chemie — een Europees tijdschrift als een "Hot Paper".
Farmaceutische bedrijven over de hele wereld hebben de afgelopen 20 tot 30 jaar geprobeerd een effectief medicijn te verzinnen om zich op K-Ras-eiwitten te richten. Wanneer K-Ras-eiwitten muteren, ze zorgen ervoor dat de vermenigvuldigingsschakelaar voortdurend aan blijft staan, een agressieve en onbehandelbare vorm van kanker worden. Bij 90 tot 100% van de moeilijke long- en pancreaskankers K-Ras zou een rol spelen. 30% van alle kankers zou een of andere vorm van Ras-mutatie hebben.
Wetenschappers hebben problemen gehad met het ontwerpen van een medicijn om K-Ras te infiltreren vanwege een gebrek aan interactieve zakken. Er werd een nieuwe strategie bedacht om de FTase aan te vallen, een belangrijk enzym bij de lipidenmodificatie van K-Ras. Zonder FTase, de gemuteerde K-Ras zou niet ongecontroleerd kunnen vermenigvuldigen. Wetenschappers hebben grote aantallen FTase-remmers ontwikkeld, maar vond het moeilijk om K-Ras modificatie te deactiveren.
Zelfs wanneer de FTase werd geremd, K-Ras-modificaties werden niet gestopt omdat GGTase I ook reageerde met de K-Ras, ondanks zijn verschillende reactieve holte. Het werd niet begrepen waarom, totdat het mechanisme werd opgehelderd dat FTase en GGTase I beide uit twee eiwitdelen bestaan, waarvan er een hetzelfde is, met exact hetzelfde DNA.
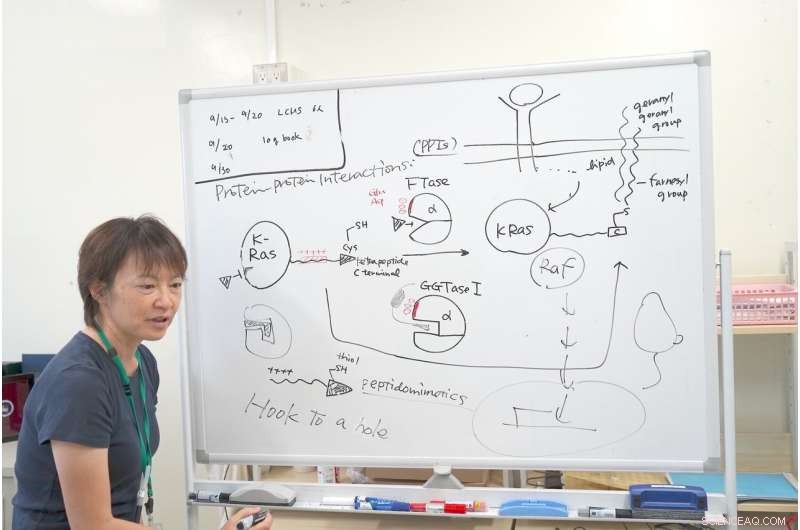
Dr. Ohkanda legt het mechanisme van haar onderzoek met K-Ras uit. Krediet:Junko Ohkanda Ph.D., Hoogleraar Academische Vergadering, Instituut voor Landbouw, Shinshu-universiteit
In de buurt van de geactiveerde holte hebben FTase en GGTase I hetzelfde cluster van zure aminozuren, zoals glutaminezuur en asparaginezuur, een negatieve lading dragen. Bij het nauwkeurig observeren van de K-Ras C-terminus, het had een interactieve positieve lading. Andere Ras-eiwitten hebben dit positief geladen gebied niet. Alleen K-Ras heeft dit cluster van positieve ladingen. Dit is de reden waarom, zelfs als de FTase werd geremd, de K-Ra's reageerden nog steeds met de GGTase I, ook al was de holte anders.
Dit is waar Dr. Ohkanda haar moment van inspiratie had. In theorie, de zak van het enzym en de cystinesleutel hechten en voegen zich samen. Maar in dit geval zijn de oppervlakken van de eiwitten, met de plus en de min ook interactie. Zelfs als de FTase wordt geremd, interageerde de K-Ras ten onrechte met de GGTase I. Dr. Ohkanda en haar collega's dachten dat ze met één verbinding twee functies konden uitoefenen.
De strategie was om een molecuul te ontwerpen dat het deel van de K-Ras nabootst dat inwerkt op de actieve pocket en ook op het zure oppervlak. Het spreekt voor zich dat de functie van het medicijn in de cel moet plaatsvinden. Grote moleculen die nuttig zijn bij eiwit-eiwitinteracties zijn vaak te groot om de cel in te gaan. Dit is een probleem waar veel medicijnontwikkelaars mee bezig zijn:leveringsmethoden.
Dr. Ohkanda dacht dat als ze rationeel de thiol aan het uiteinde van de K-Ra's kon ontwerpen om aan de actieve zak van de FTase en GGTase I te haken, het verlengde interactieve positieve ladingsgedeelte zou een interactie kunnen aangaan en het celmembraan kunnen binnendringen. Als het cysteïnegedeelte in de holte zou kunnen haken, de verbonden interactieve positieve keten kan klein zijn en strategisch aan het zure oppervlak van de enzymen worden afgeleverd. Het was moeilijk om de grootte van de verbinding te minimaliseren terwijl de stabiliteit ervan werd verhoogd en het vermogen voor chemische reacties behouden bleef. Door een peptidomimetica van dezelfde lengte en dezelfde sleutel te gebruiken, ze waren in staat om in vitro met succes de cel binnen te dringen, het verstoren van de op hol geslagen K-Ras-vermenigvuldiging.
Er zijn meer studies nodig om de activiteit van de verbinding te verhogen, in vivo testen en de toxiciteit ervan evalueren lang voordat de verbinding kan worden gebruikt als een behandeling voor kankers. Dr. Ohkanda blijft werken met een internationaal team van experts om het werkingsmechanisme en hun interacties op te helderen om rationeel effectieve medicijnen te ontwerpen om de vermenigvuldiging van dergelijke cellen te stoppen.
 Betere afvalwaterzuivering in India met Nederlandse expertise
Betere afvalwaterzuivering in India met Nederlandse expertise Hoeveel olie produceert en importeert de VS?
Hoeveel olie produceert en importeert de VS?  NASA-satellietgegevens laten zien dat Tapah extra-tropisch wordt
NASA-satellietgegevens laten zien dat Tapah extra-tropisch wordt Versteende vissen kunnen wijzen op rijke afzettingen van waardevolle zeldzame aardmetalen
Versteende vissen kunnen wijzen op rijke afzettingen van waardevolle zeldzame aardmetalen NASA ziet centrale en zuidelijke Filipijnen zich schrap zetten voor tropische depressie 02W
NASA ziet centrale en zuidelijke Filipijnen zich schrap zetten voor tropische depressie 02W
Hoofdlijnen
- Hoe een celmodel te maken met Playdough
- Hoe vergif Sumac te behandelen?
- De Atlantische steuren verblijven
- Nieuwe kaarten laten zien dat de krimpende wildernis op eigen risico wordt genegeerd
- Individuele genomen van patiënten kunnen de werkzaamheid beïnvloeden, veiligheid van het bewerken van genen
- Puin van de tsunami van 2011 bracht honderden soorten over de Stille Oceaan
- Kunnen eukaryoten overleven zonder mitochondria?
- Big data helpt onderzoekers in de strijd om plantenindringers onder controle te krijgen
- Microbieel moordmysterie opgelost
- Synthetische organellen laten zien hoe kleine plas-organen in onze cellen werken
- Onderzoekers boeken vooruitgang in ontziltingstechnologie

- Een nieuwe manier om kogelvrije vesten te testen

- Ook na handen wassen, nieuwe vingerafdruktest kan onderscheid maken tussen personen die heroïne hebben gebruikt of gebruikt

- De 120 jaar oude cold case voor de Grignard-reactie is eindelijk opgelost
 Bosbranden produceren mineralen die wolken bevriezen
Bosbranden produceren mineralen die wolken bevriezen Grootste virtuele universum gratis voor iedereen om te verkennen
Grootste virtuele universum gratis voor iedereen om te verkennen Nieuwe nanodeeltjestechnologie ontwikkeld om agressieve schildklierkanker te behandelen
Nieuwe nanodeeltjestechnologie ontwikkeld om agressieve schildklierkanker te behandelen Angst in Alaska terwijl eindeloze naschokken bewoners rammelen
Angst in Alaska terwijl eindeloze naschokken bewoners rammelen Analyse-ID's en praktijken om overstromingen te bestrijden, droogte
Analyse-ID's en praktijken om overstromingen te bestrijden, droogte Gecontroleerde verwarming van gouden nanodeeltjes
Gecontroleerde verwarming van gouden nanodeeltjes Nieuw POP-atoomklokontwerp zorgt voor ultramoderne frequentiestabiliteit
Nieuw POP-atoomklokontwerp zorgt voor ultramoderne frequentiestabiliteit Eddington,
Eddington,
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com

