
Wetenschap
Wat is de meest waarschijnlijke reactie tussen ammoniak en een watermolecuul?
Dit is waarom:
* polariteit: Zowel ammoniak als water zijn polaire moleculen. Het stikstofatoom in ammoniak en het zuurstofatoom in water hebben een gedeeltelijke negatieve lading, terwijl de waterstofatomen een gedeeltelijke positieve lading hebben.
* waterstofbinding: De gedeeltelijk positieve waterstofatomen in water kunnen waterstofbruggen vormen met het enige paar elektronen op het stikstofatoom in ammoniak. Deze waterstofbindingen zijn relatief zwak, maar zijn belangrijk voor de eigenschappen van zowel ammoniak als water.
Hier is de chemische vergelijking die de interactie vertegenwoordigt:
NH₃ + H₂o → NH₃… H₂o
De stippellijn geeft een waterstofbinding aan.
Hoewel ammoniak ook kan reageren met water om ammoniumionen (NH₄⁺) en hydroxide -ionen te vormen (OH⁻), is deze reactie minder waarschijnlijk in aanwezigheid van alleen water. Deze reactie vereist een aanzienlijke hoeveelheid energie om de sterke bindingen in het watermolecuul te doorbreken.
Laat het me weten als je meer details wilt over een van deze reacties!
 Waarom wordt de reactie beperkt door een hoeveelheid van één stof?
Waarom wordt de reactie beperkt door een hoeveelheid van één stof?  Welke stof is bestand tegen veranderingen in de pH-waarde?
Welke stof is bestand tegen veranderingen in de pH-waarde?  Nieuw coatingmateriaal voor chirurgische instrumenten
Nieuw coatingmateriaal voor chirurgische instrumenten Welke van deze heeft geen duidelijke volume gasvloeistofmateriaal vaste stof?
Welke van deze heeft geen duidelijke volume gasvloeistofmateriaal vaste stof?  Welk chemisch element verleent de gele kleur die wordt waargenomen in vuurwerkdisplays?
Welk chemisch element verleent de gele kleur die wordt waargenomen in vuurwerkdisplays?
 Idiotfruit en boomkangoeroes:waarom de oude regenwouden van de natte tropen van Queensland zo onderscheidend zijn
Idiotfruit en boomkangoeroes:waarom de oude regenwouden van de natte tropen van Queensland zo onderscheidend zijn  Welke 7 plantenkenmerken heeft Gregor Mendel bestudeerd?
Welke 7 plantenkenmerken heeft Gregor Mendel bestudeerd?  Nederlandse traktatie:Philadelphia Flower Show viert Nederland
Nederlandse traktatie:Philadelphia Flower Show viert Nederland  What Sounds Frighten Birds?
What Sounds Frighten Birds?  Overstromingen beïnvloeden de reactietijd bij noodgevallen in Engeland
Overstromingen beïnvloeden de reactietijd bij noodgevallen in Engeland
Hoofdlijnen
- Hoe helpen stambomen ons te begrijpen hoe eigenschappen worden doorgegeven?
- Hoe kunnen onderzoeken bij ratten van toepassing zijn op mensen?
- Opslagkamers binnen een cel heten?
- Welke soorten cellen en organismen ondergaan mitose en meiose?
- Wat is een protozoa die duivenmalaria veroorzaakt?
- Nieuw wiskundig model legt uit hoe gastheren parasietaanvallen overleven
- Onderzoekers ontwikkelen een systeem om te beoordelen hoe effectief soorten zijn bij het bestuiven van gewassen
- Welke 2 dingen kunnen enzymactiviteit beïnvloeden?
- Wat is de functie van borstelreiniger in het laboratorium?
- Onderzoekers ontdekken zeer actieve organische fotokatalysator
- Microfluïdische chip kan bijwerkingen van radiotherapie verminderen
- Wetenschappers lossen structuur van eiwit met verstandelijke beperking op

- Elektriciteit gebruiken om chemie een boost te geven

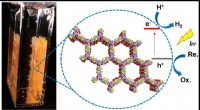
- Naar de zon kijken om waterstofbrandstof te maken

 Offline Math Games
Offline Math Games Hoeveel mensen geloven in de evolutietheorie?
Hoeveel mensen geloven in de evolutietheorie?  Team ontwikkelt nieuw laserverdedigingssysteem tegen autonome drones
Team ontwikkelt nieuw laserverdedigingssysteem tegen autonome drones Is boor hetzelfde als citraat?
Is boor hetzelfde als citraat?  Waarom houdt u uw huis zo koud? Uit onderzoek blijkt dat de temperatuur in huis in de kindertijd de thermostaatinstellingen van volwassenen kan voorspellen
Waarom houdt u uw huis zo koud? Uit onderzoek blijkt dat de temperatuur in huis in de kindertijd de thermostaatinstellingen van volwassenen kan voorspellen  Multifunctionele gouden nanodeeltjes zijn veelbelovend in combinatietherapie
Multifunctionele gouden nanodeeltjes zijn veelbelovend in combinatietherapie  Het verschil tussen een watervoerende laag en de watertafel
Het verschil tussen een watervoerende laag en de watertafel Waarom is het menselijk ras zo dirkerend?
Waarom is het menselijk ras zo dirkerend?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

