
Wetenschap
Hoeveel atomen van lithium zijn er in 11,8 g?
Hier leest u hoe u het aantal lithiumatomen in 11,8 g kunt berekenen:
1. Vind de molaire massa lithium:
* De molaire massa van lithium (Li) is 6.941 g/mol (u kunt dit vinden op het periodieke tabel).
2. Bereken het aantal mol lithium:
* Verdeel de gegeven massa door de molaire massa:
* mol Li =11,8 g / 6.941 g / mol =1,70 mol
3. Converteer mollen naar atomen met behulp van het nummer van Avogadro:
* Avogadro's nummer is 6.022 x 10^23 atomen/mol
* Vermenigvuldig het aantal mol met het nummer van Avogadro:
* Atomen van Li =1,70 mol * 6.022 x 10^23 atomen/mol =1,02 x 10^24 atomen
Daarom zijn er ongeveer 1,02 x 10^24 atomen van lithium in 11,8 g.
 Wat is het recyrstallisatie -oplosmiddel voor Benzocaine?
Wat is het recyrstallisatie -oplosmiddel voor Benzocaine?  Wat is de chemische formule voor oxiden?
Wat is de chemische formule voor oxiden?  Wanneer waterdamp koud wordt, verandert het in wat?
Wanneer waterdamp koud wordt, verandert het in wat?  Hoe kun je een onbekende kristallijne stof testen om te bepalen of het keukenzout is?
Hoe kun je een onbekende kristallijne stof testen om te bepalen of het keukenzout is?  Onderzoek identificeert het belangrijkste ingrediënt voor betaalbare brandstofcelkatalysatoren
Onderzoek identificeert het belangrijkste ingrediënt voor betaalbare brandstofcelkatalysatoren
 Wat zijn twee belangrijke milieu -uitdagingen waarmee de samenleving wordt geconfronteerd?
Wat zijn twee belangrijke milieu -uitdagingen waarmee de samenleving wordt geconfronteerd?  Wat is het belang van een regenwoud?
Wat is het belang van een regenwoud?  Hoe communicatie over milieukwesties de politieke kloof kan overbruggen
Hoe communicatie over milieukwesties de politieke kloof kan overbruggen  Wat is het oppervlak van het oppervlak en de onmiddellijke atmosfeer die het leven ondersteunt?
Wat is het oppervlak van het oppervlak en de onmiddellijke atmosfeer die het leven ondersteunt?  Flat pack recyclebare noodopvangcentra om slachtoffers van orkanen te helpen
Flat pack recyclebare noodopvangcentra om slachtoffers van orkanen te helpen
Hoofdlijnen
- Kunnen we mannelijke en vrouwelijke protoceratopen gemakkelijk onderscheiden?
- Onderzoekers laten zien hoe spoorwegwormen rood licht produceren
- Wie heeft vastgesteld hoe eigenschappen worden doorgegeven tijdens de reproductie?
- Rudolph, waarom is je neus zo helder? Wetenschappers van Johns Hopkins hebben een idee
- Het bacteriële sociale netwerk hacken
- Welk type cellulaire ademhaling treedt op met zuurstof?
- Welk oceaandier heeft radiale lichaamssymmetrie?
- Zijn bonen een base of een zuur?
- Welke functie dienen de meeste stamcellen en volwassenen?
- Voor het opsporen van misdaad en vermiste personen, wetenschap steunt bloeddetectiehonden

- Een slim isotopenscheidingssysteem ontwikkelen
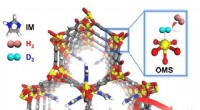
- Splashdown:Supersonische koudmetaalverbinding in 3D

- Nieuwe genomische methode onthult atomaire rangschikkingen van batterijmateriaal
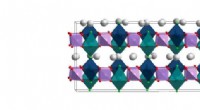
- Onderzoekers gebruiken neurale netwerken voor geurherkenning

 Zijn de deeltjes van een gas bij elkaar gehouden door sterke aantrekkelijke krachten?
Zijn de deeltjes van een gas bij elkaar gehouden door sterke aantrekkelijke krachten?  Met streaming verplaatsen, Google kijkt naar de toekomst van gaming
Met streaming verplaatsen, Google kijkt naar de toekomst van gaming Nieuw computermodel automatisch, foto's esthetisch bijsnijden
Nieuw computermodel automatisch, foto's esthetisch bijsnijden AP legt uit:Hoe groot is een elektromagnetische aanval?
AP legt uit:Hoe groot is een elektromagnetische aanval?  Hoe beïnvloedt verwarming de oplosbaarheid van een opgeloste gas in vloeistof?
Hoe beïnvloedt verwarming de oplosbaarheid van een opgeloste gas in vloeistof?  Studie biedt nieuwe aanwijzingen voor het verbeteren van chemotherapie
Studie biedt nieuwe aanwijzingen voor het verbeteren van chemotherapie Uw klanten empoweren? Denk twee keer na over campagnes op sociale media
Uw klanten empoweren? Denk twee keer na over campagnes op sociale media  Wat maakt quasars anders dan andere sterren?
Wat maakt quasars anders dan andere sterren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

