
Wetenschap
Wat is Oxygens -lading?
Dit is waarom:
* Neutraal atoom: Een zuurstofatoom heeft 8 protonen (positieve lading) en 8 elektronen (negatieve lading). Deze ladingen balanceren, waardoor het atoom elektrisch neutraal wordt.
* Oxidatie stelt: Zuurstof is zeer elektronegatief, wat betekent dat het elektronen sterk aantrekt. In verbindingen wint het vaak elektronen en vormt het een negatieve oxidatietoestand , meestal -2. Dit betekent niet dat het een permanente lading heeft, maar het duidt eerder op de relatieve elektronenverdeling in de verbinding.
Voorbeelden:
* water (h₂o): Zuurstof deelt elektronen met twee waterstofatomen, waardoor het een -2 oxidatietoestand heeft.
* koolstofdioxide (co₂): Zuurstof deelt elektronen met koolstof, opnieuw met een -2 oxidatietoestand.
ionen: Zuurstof kan een ion vormen dat oxide (o²⁻) wordt genoemd door twee elektronen te winnen. Deze ion heeft een -2 lading.
Samenvattend:
* Oxygenatoom: Neutrale.
* Zuurstof in verbindingen: Heeft vaak een -2 oxidatietoestand.
* oxide -ion: -2 lading.
 Waarom we een betere filosofie van bomen nodig hebben
Waarom we een betere filosofie van bomen nodig hebben Onderzoekers ontwikkelen nieuwe methoden voor het beoordelen van het risico van ondergronds fosfor
Onderzoekers ontwikkelen nieuwe methoden voor het beoordelen van het risico van ondergronds fosfor Meer van ons drinken gerecycled rioolwater dan de meeste mensen beseffen
Meer van ons drinken gerecycled rioolwater dan de meeste mensen beseffen Stijgende zeeën en smeltende gletsjers zijn nu onomkeerbaar, maar we moeten handelen om ze te vertragen
Stijgende zeeën en smeltende gletsjers zijn nu onomkeerbaar, maar we moeten handelen om ze te vertragen Opschudding terwijl Oeganda een plan nastreeft om waterval in nationaal park af te dammen
Opschudding terwijl Oeganda een plan nastreeft om waterval in nationaal park af te dammen
Hoofdlijnen
- Hoe verschilt cauka's van primair?
- Genetici lossen een veertig jaar oud dilemma op om te verklaren waarom dubbele genen in het genoom achterblijven
- Hoe herpes de productiemiddelen van eiwitten in beslag neemt
- Mensen geven de voorkeur aan gekweekte zalm, zolang ze niet weten wat ze eten
- Zou de micro-ecologie worden beschadigd door een plastic film die een schadelijk bodeminsect doodt?
- Hoe klonen werkt
- Wat zijn enkele voedselvoorbeelden van eiwitten?
- Onderzoekers ontdekken hoe dieren hun puntige lichaamsdelen laten groeien
- Stamcellen tonen de kracht om ziekten en medicijntoxiciteit te voorspellen
- Ammoniak voor brandstofcellen

- Nieuw superomnifoob glas zweeft hoog op vlindervleugels met behulp van machine learning

- Nieuwe strategie maakt opeenvolgende splitsing en functionalisering van C–C-bindingen in alcoholen mogelijk
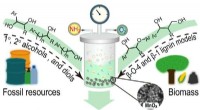
- Wetenschappers tonen een betere, milieuvriendelijkere methode om waterstofperoxide te produceren

- Betere thermo-elektrische eigenschappen bereikt in n-type composiet

 Hoe mm omzetten naar fractionele inch
Hoe mm omzetten naar fractionele inch De man uit de ijzertijd met het eerste bekende geval van tbc in Groot-Brittannië was een migrant uit continentaal Europa
De man uit de ijzertijd met het eerste bekende geval van tbc in Groot-Brittannië was een migrant uit continentaal Europa Malawi wendt zich tot Britse troepen in stropersoorlog
Malawi wendt zich tot Britse troepen in stropersoorlog Bewijs ontdekt voor twee verschillende populaties van reuzenplaneten
Bewijs ontdekt voor twee verschillende populaties van reuzenplaneten Vroege systemen voor classificerende planten waren gebaseerd op kenmerken die mensen gemakkelijk konden zien omdat?
Vroege systemen voor classificerende planten waren gebaseerd op kenmerken die mensen gemakkelijk konden zien omdat?  Hoe beïnvloedt concentratie de reactiesnelheid?
Hoe beïnvloedt concentratie de reactiesnelheid?
Verhogen van de concentratie van reactanten verhoogt in het algemeen de reactiesnelheid omdat meer van de reagerende moleculen of ionen aanwezig zijn om de reactieproducten te vormen. Dit is vooral
 Huismisbruikers gebruiken technologie die verbinding maakt als wapen tijdens coronavirusvergrendelingen
Huismisbruikers gebruiken technologie die verbinding maakt als wapen tijdens coronavirusvergrendelingen Lab doorbraak in 3D printen van glas
Lab doorbraak in 3D printen van glas
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

