
Wetenschap
Wat is de moleculaire vorm van een watermolecuul en waarom?
* Elektronenconfiguratie van Oxygen: Zuurstof heeft zes elektronen in de buitenste schaal en hebben er nog twee nodig om een stabiel octet te bereiken.
* waterstofbinding: Elk waterstofatoom deelt één elektron met het zuurstofatoom en vormt een enkele covalente binding.
* eenzame paren: Zuurstof heeft twee eenzame paren elektronen die niet betrokken zijn bij binding.
* afstoting: De enige paren op de zuurstofatoom stoten de bindingsparen af en duwen de waterstofatomen dichter bij elkaar.
* resulterende vorm: Deze afstoting creëert een gebogen of V-vorm, waarbij de hoek tussen de twee waterstofatomen ongeveer 104,5 graden is.
Samenvattend: De twee enige paren op het zuurstofatoom in een watermolecuul veroorzaken een significante afstoting die resulteert in een gebogen moleculaire vorm.
 De utilitaire benadering van het wereldwijde klimaatbeleid verbetert de rechtvaardigheid, milieu en welzijn
De utilitaire benadering van het wereldwijde klimaatbeleid verbetert de rechtvaardigheid, milieu en welzijn Loodvervuiling door indianen toegeschreven aan verpletterende galena voor glitterverf
Loodvervuiling door indianen toegeschreven aan verpletterende galena voor glitterverf 'Gecko vision':sleutel tot de multifocale contactlens van de toekomst?
'Gecko vision':sleutel tot de multifocale contactlens van de toekomst?  De voordelen van een verbrandingsinstallatie voor vast afval
De voordelen van een verbrandingsinstallatie voor vast afval  Een verhaal van plaats herstellen - verhalen in de tijd van klimaatverandering
Een verhaal van plaats herstellen - verhalen in de tijd van klimaatverandering
Hoofdlijnen
- Onderzoeker schetst hoe de sensorische systemen van walvissen zijn geëvolueerd door middel van beeldtechnologie
- Vorm een hypothese over de massa en het volume van een mol spliterwten?
- Als een DNA-streng de sequentie heeft, zal aagctc-transcriptie resulteren in?
- Waarom is de Steenbokskeerkring belangrijk?
- Is een ribosoom -organisme met één cel?
- Wat is een voorbeeld van postzygotische isolatie?
- Wat zijn de fysieke eigenschappen van de Griekse God?
- Uit de problemen komen:helpt mobiel DNA?
- Het kenmerk van een zenuwcel die rechtstreeks verband houdt met zijn functie bij het ontvangen en verzenden van impulsen is wat?
- CRISPR:Meer dan alleen voor het bewerken van genen?

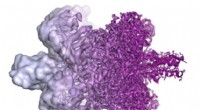
- Labtechnologie brengt Nobelprijswinnaar cryo-EM scherper in beeld
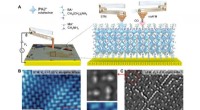
- Niet-invasieve beeldvorming van atomaire rangschikking op sub-angstromschaal in 2D hybride perovskieten
- Vooruitgang in de richting van het aansluiten van een antibioticapomp

- Wetenschappers krijgen atomistisch beeld van afbraak van platinakatalysator

 Heeft COVID 19 de rechtsstaat ondermijnd? Nieuw onderzoek onderzoekt acties in de Westelijke Balkan
Heeft COVID 19 de rechtsstaat ondermijnd? Nieuw onderzoek onderzoekt acties in de Westelijke Balkan Een aardappellamp maken
Een aardappellamp maken NASA-satellietbeelden vinden dat Typhoon Halong lijkt op een bokshandschoen
NASA-satellietbeelden vinden dat Typhoon Halong lijkt op een bokshandschoen Hoe het luisteren naar willekeurig geluid een gevangen geest kan ontgrendelen
Hoe het luisteren naar willekeurig geluid een gevangen geest kan ontgrendelen Onderzoekers ontdekken hoe het dunner worden van de vegetatie de muilezelhertenpopulatie in New Mexico beïnvloedt
Onderzoekers ontdekken hoe het dunner worden van de vegetatie de muilezelhertenpopulatie in New Mexico beïnvloedt  Onderzoekers die pulsarmetingen gebruiken om donkere materie te onderzoeken, ontdekken dat het Melkwegstelsel zeer dynamisch is
Onderzoekers die pulsarmetingen gebruiken om donkere materie te onderzoeken, ontdekken dat het Melkwegstelsel zeer dynamisch is  Waarom heeft het leger een Javelin-raketsimulator?
Waarom heeft het leger een Javelin-raketsimulator?  Vlindervleugels + koolstof nanobuisjes =nieuw nanobiocomposiet materiaal
Vlindervleugels + koolstof nanobuisjes =nieuw nanobiocomposiet materiaal
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

