
Wetenschap
Waarom is de structuur van OF2 niet lineair?
1. Elektronegativiteit: Zuurstof is elektronegatiefer dan fluor. Dit betekent dat het zuurstofatoom de gedeelde elektronen in de O-F-bindingen sterker aantrekt, wat resulteert in een gedeeltelijke negatieve lading op zuurstof en een gedeeltelijke positieve lading op de fluoratomen.
2. Lone paren: Zuurstof heeft twee eenzame paren elektronen in zijn valentieschil. Deze alleenstaande paren oefenen een sterke afstotende kracht uit op de bindingsparen van elektronen in de O-F-bindingen.
3. VSEPR -theorie: Volgens de Valent Shell Electron Pair Repulsion (VSEPR) -theorie proberen elektronenparen, zowel binding als niet-bindend, de afstoting te minimaliseren door zichzelf zo ver mogelijk uit elkaar te positioneren. In het geval van 2 , De optimale opstelling om afstoting te minimaliseren is een gebogen vorm met een bindingshoek van ongeveer 103,3 graden.
Daarom leidt de combinatie van de elektronegativiteit van zuurstof en de aanwezigheid van alleenstaande paren op zuurstof tot de gebogen vorm van 2 , in plaats van een lineaire structuur.
 Ozongat is zowel een succesverhaal voor het milieu als een wereldwijde bedreiging
Ozongat is zowel een succesverhaal voor het milieu als een wereldwijde bedreiging Wat is het dichtstbijzijnde natuurlijke lichaam aan de aarde?
Wat is het dichtstbijzijnde natuurlijke lichaam aan de aarde?  Vaardigheid en handicap:hoe we ze kunnen herkennen, hoe we het allemaal beter kunnen doen
Vaardigheid en handicap:hoe we ze kunnen herkennen, hoe we het allemaal beter kunnen doen  Gids voor tropische regenwouden:hoe regenwouden werken
Gids voor tropische regenwouden:hoe regenwouden werken  Ongewone sneeuw doodt 4, brengt een groot deel van Spanje tot stilstand
Ongewone sneeuw doodt 4, brengt een groot deel van Spanje tot stilstand
Hoofdlijnen
- Dierlijke cellen hebben veel mitochondriën die ze snel waar of onwaar moeten contracteren?
- Wat zijn de locomotaire organellen in Paramecium en Euglena?
- Gestratificeerd epitheelweefsel: definitie, structuur, typen
- Wat doet fruit voor je lichaam?
- Welke cel draagt berichten van en naar het verschillende onderdelenlichaam?
- Waarom leven kleine honden langer dan grote honden?
- Hoe zijn virussen, viroïden en prionen verwant?
- Bacteriën in de dikke darm zijn belangrijk omdat ze belangrijk synthetiseren?
- Hoe lepra werkt
- Wetenschappers demonstreren hoe staaleigenschappen kunnen worden verbeterd

- Chemici ontwikkelen een nieuwe methode voor de synthese van polymere nanodeeltjes van een bepaalde grootte
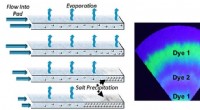
- Op papier gebaseerd apparaat biedt een laag stroomverbruik, langetermijnmethode voor het analyseren van zweet
- Atomaire structuur van aluminiumlegeringen bestuderen voor de fabricage van moderne vliegtuigen

- Zo ontdek je snel nieuwe materialen

 Genetische prehistorie van Iberia verschilt van Midden- en Noord-Europa
Genetische prehistorie van Iberia verschilt van Midden- en Noord-Europa Team presenteert een nieuw pad naar gegevensopslag op de lange termijn, gebaseerd op defecten op atomaire schaal
Team presenteert een nieuw pad naar gegevensopslag op de lange termijn, gebaseerd op defecten op atomaire schaal  Het aanpakken van verborgen honger in ontwikkelingslanden:studie onderzoekt genetische informatie van gierst
Het aanpakken van verborgen honger in ontwikkelingslanden:studie onderzoekt genetische informatie van gierst  Hoe afstand van licht te berekenen
Hoe afstand van licht te berekenen Kunstmatige intelligentie voorspelt nauwkeurig de verspreiding van radioactieve neerslag
Kunstmatige intelligentie voorspelt nauwkeurig de verspreiding van radioactieve neerslag Bij het afstemmen van wrijving tot het punt waarop het verdwijnt, techniek zou de ontwikkeling van nanomachines kunnen stimuleren
Bij het afstemmen van wrijving tot het punt waarop het verdwijnt, techniek zou de ontwikkeling van nanomachines kunnen stimuleren Wat is het hoogste gebouw ter wereld?
Wat is het hoogste gebouw ter wereld?  Litouwen ontwikkelen een afhaalmaaltijdenpakket dat volledig plasticvrij is
Litouwen ontwikkelen een afhaalmaaltijdenpakket dat volledig plasticvrij is
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

