
Wetenschap
Waarom is het pH -bereik vastgesteld?
Dit is waarom:
* De pH -schaal is logaritmisch: Dit betekent dat elke gehele getalverandering in pH een tienvoudige verandering in H+ -concentratie vertegenwoordigt. Een oplossing met een pH van 3 heeft bijvoorbeeld tien keer meer H+ dan een oplossing met een pH van 4.
* De schaal is gebaseerd op de autoionisatie van water: Watermoleculen dissociëren van nature in H+ en OH-ionen. Dit creëert een zeer kleine maar belangrijke concentratie van H+ in zuiver water, die het neutrale punt van de schaal bij pH 7 definieert.
* De schaal heeft theoretische limieten: Theoretisch kan de pH -schaal verder gaan dan 0 en 14, maar in de praktijk is het moeilijk om oplossingen te creëren met extreem hoge of lage H+ -concentraties als gevolg van beperkingen in chemische reacties en meettechnieken.
Samenvattend is de pH -schaal niet vast, maar een dynamisch systeem dat de relatieve concentratie van waterstofionen in een oplossing weerspiegelt. Het is een hulpmiddel voor het kwantificeren en vergelijken van de zuurgraad of alkaliteit van verschillende stoffen.
 We zouden een nieuwe groene beweging kunnen stimuleren door te praten over energieverandering
We zouden een nieuwe groene beweging kunnen stimuleren door te praten over energieverandering Baanbrekende zwemplek in het kanaal van Parijs gesloten vanwege vervuiling
Baanbrekende zwemplek in het kanaal van Parijs gesloten vanwege vervuiling Waarom gaat het gelukkige medium er niet over om naar de aarde te kijken die in de tijd rimpelt?
Waarom gaat het gelukkige medium er niet over om naar de aarde te kijken die in de tijd rimpelt?  De mysterieuze luminescentieverschijnselen van aardbevingsbliksem
De mysterieuze luminescentieverschijnselen van aardbevingsbliksem Permafrost-koolstoffeedback bedreigt wereldwijde klimaatdoelen
Permafrost-koolstoffeedback bedreigt wereldwijde klimaatdoelen
Hoofdlijnen
- Wat is een eukaryote en hoe geclassificeerd?
- Hoe wordt de menselijke mannelijke gameet genoemd?
- Onzekerheid vertroebelt VN-besprekingen over biopiraterijverdrag
- Wie is jouw papa? Als je een gorilla bent, maakt het niet uit
- Wat volgt glycolyse als zuurstof aanwezig is?
- Wetenschappers tonen aan dat ribosomen een onverwachte rol spelen bij de vorming van bloedvaten
- Wat is chloorflukoolstof?
- In welk deel van de plant bewaren aardappelen hun zetmeel?
- Bioloog uit Syracuse onthult hoe walvissen kunnen 'zingen' voor hun avondeten
- Nieuw onderzoek kan zorgen voor betere voeding en snellere analyse van bloedonderzoeken

- Wetenschappers onderzoeken toekomstig gebruik van op bacteriën gebaseerde actieve stoffen

- Gerichte evolutie opent deur naar nieuwe antibiotica
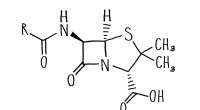
- Nieuwe methode om voorlopers te produceren voor koolstofvezelverwerking met hoge sterkte

- Energiestroom in het nanobereik
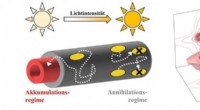
 Een soort modderstroom geassocieerd met gewelddadige uitbarstingen?
Een soort modderstroom geassocieerd met gewelddadige uitbarstingen?  Satcom om veerkrachtige digitale systemen te bevorderen
Satcom om veerkrachtige digitale systemen te bevorderen Waar bevindt onze zon zich op de Melkweg?
Waar bevindt onze zon zich op de Melkweg?  Waarom is onze energie afhankelijk van de lichaamsmassa?
Waarom is onze energie afhankelijk van de lichaamsmassa?  Wat zijn twee manieren waarop cellen kunnen verschillen?
Wat zijn twee manieren waarop cellen kunnen verschillen?  Californische aardbeienvelden zijn misschien niet voor altijd. Kunnen robots helpen?
Californische aardbeienvelden zijn misschien niet voor altijd. Kunnen robots helpen? Wat een zinkend eiland ons kan vertellen over zeespiegelveranderingen en aardbevingen
Wat een zinkend eiland ons kan vertellen over zeespiegelveranderingen en aardbevingen Kunnen vaste voorwerpen licht doorlaten?
Kunnen vaste voorwerpen licht doorlaten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

