
Wetenschap
Waarom zijn elementen die 1 elektron verkrijgen of verliezen de meest actieve metalen niet -metalen?
Hier is een uitsplitsing:
* metalen hebben de neiging om te verliezen elektronen om een stabiele elektronenconfiguratie te bereiken.
* niet -metalen hebben de neiging om te winnen elektronen om een stabiele elektronenconfiguratie te bereiken.
Elementen die één elektron gemakkelijk verkrijgen of verliezen, zijn over het algemeen meer reactief, maar dit maakt ze niet automatisch de meest actieve.
Dit is waarom:
* reactiviteit hangt af van meerdere factoren: Het gemak van het verkrijgen of verliezen van elektronen (ionisatie -energie voor metalen en elektronenaffiniteit voor niet -metalen) is slechts één factor die de reactiviteit bepaalt. Andere factoren zijn:
* Grootte van het atoom: Kleinere atomen zijn meestal reactiever.
* elektronegativiteit: Het vermogen van een atoom om elektronen aan te trekken.
* Nucleaire lading: Een hogere nucleaire lading kan de reactiviteit verhogen.
* Groepstrends: De meest reactieve metalen worden meestal gevonden in groep 1 (alkali -metalen) en groep 2 (alkalische aardmetalen) van het periodiek systeem. Ze verliezen respectievelijk een of twee elektronen. De meest reactieve niet -metalen zijn te vinden in groep 17 (halogenen), die gemakkelijk één elektron krijgen.
* Uitzonderingen: Hoewel elementen die één elektron winnen of verliezen vaak zeer reactief zijn, zijn er uitzonderingen. Sommige elementen in het midden van het periodiek systeem kunnen bijvoorbeeld meerdere elektronen verliezen of verkrijgen, wat leidt tot verschillende niveaus van reactiviteit.
Conclusie:
Hoewel het aantal verkregen of verloren elektronen een factor kan zijn in de reactiviteit, is dit niet de enige bepalende factor. De meest actieve metalen en niet -metalen zijn die die een sterke neiging vertonen om respectievelijk elektronen te verliezen of te winnen, vanwege een combinatie van factoren zoals atoomgrootte, elektronegativiteit en nucleaire lading.
 Meer reactieve landoppervlakken koelden de aarde af
Meer reactieve landoppervlakken koelden de aarde af Mierenkolonies van bladsnijders kunnen een over het hoofd geziene bron van kooldioxide-emissies zijn, nieuwe studie vondsten
Mierenkolonies van bladsnijders kunnen een over het hoofd geziene bron van kooldioxide-emissies zijn, nieuwe studie vondsten Wat is het wetenschappelijke woord voor het vermogen om van locatie te veranderen?
Wat is het wetenschappelijke woord voor het vermogen om van locatie te veranderen?  Blootstelling aan frackingchemicaliën en afvalwater stimuleert de ontwikkeling van vetcellen
Blootstelling aan frackingchemicaliën en afvalwater stimuleert de ontwikkeling van vetcellen Gezond klimaatnieuws:tuinbonen kunnen soja vervangen
Gezond klimaatnieuws:tuinbonen kunnen soja vervangen
Hoofdlijnen
- Je bent wat je eet is net zo belangrijk voor vissen als voor mensen
- Zeer uiteenlopende skinks bieden inzicht in hoe evolutie werkt
- Herstel van de Braziliaanse Spixs-ara, gepopulariseerd in geanimeerde Rio-films, bedreigd door klimaatverandering
- Hoe hoge bomen suikers verplaatsen
- Wat is variabelen in het wetenschapsonderzoeksproject?
- Herten geven de voorkeur aan inheemse planten die blijvende schade aan bossen achterlaten
- Hoeveel genen zijn er nodig om te leren? Lessen van zeeslakken
- Beschermde zones van het Great Barrier Reef helpen vissen in zelfs licht geëxploiteerde gebieden
- Waar vindt de overdracht van genetische informatie van DNA naar RNA plaats?
- Nieuwe grens voor 3D-printen ontwikkelt ultramoderne zachte materialen die zichzelf kunnen herstellen

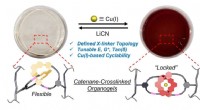
- In elkaar grijpende ringen ontgrendelen nieuwe materiaaleigenschappen
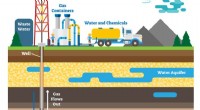
- Mechanisme dat verantwoordelijk is voor het maken van gehalogeneerde organische verbindingen bij fracken ontdekt
- Je gelooft het maar:caloriearme spread voornamelijk gemaakt van water

- Bacteriële enzymen gekaapt om complexe moleculen te maken die normaal door planten worden gemaakt
 Wat is de maan Ecplise?
Wat is de maan Ecplise?  Hoe kan energie aardbevingen creëren?
Hoe kan energie aardbevingen creëren?  Schaamte of hoop? Hoe moeten we ons voelen over de klimaatverandering?
Schaamte of hoop? Hoe moeten we ons voelen over de klimaatverandering?  Een nieuwe L-fucose metabolische route van strikt anaërobe en pathogene bacteriën
Een nieuwe L-fucose metabolische route van strikt anaërobe en pathogene bacteriën Uit watertests blijkt dat een paar huizen in het dorp Ohio nog steeds lood bevatten
Uit watertests blijkt dat een paar huizen in het dorp Ohio nog steeds lood bevatten  Studies onderzoeken de behoefte aan en de impact van cultureel bewuste mentorschapstraining
Studies onderzoeken de behoefte aan en de impact van cultureel bewuste mentorschapstraining Hoe smelt je het element Mercurius?
Hoe smelt je het element Mercurius?  Is Leucocyten kleurloos deel in je lichaam?
Is Leucocyten kleurloos deel in je lichaam?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

