
Wetenschap
H3o Plus is een polair of niet -polair molecuul?
* Vorm: Het centrale zuurstofatoom in H3O+ heeft vier elektronenparen eromheen, waarvan er drie zijn gebonden aan waterstofatomen. Dit geeft het een tetraëdrische vorm , vergelijkbaar met methaan (CH4).
* elektronegativiteit: Zuurstof is aanzienlijk elektronegatief dan waterstof. Dit betekent dat zuurstof de gedeelde elektronen in de O-H-bindingen sterker aantrekt, waardoor een gedeeltelijke negatieve lading (A-) op de zuurstof- en gedeeltelijke positieve ladingen (δ+) op de hydrogenen ontstaat.
* asymmetrie: De tetraëdrische vorm, gecombineerd met de ongelijke verdeling van de elektronendichtheid, resulteert in een algemene asymmetrische verdeling van ladingen .
Daarom heeft H3O+ een netto dipoolmoment, waardoor het een polair molecuul is.
 De rol van chemie in het dagelijks leven?
De rol van chemie in het dagelijks leven?  2 Hoe kunt u cohesie en hechting verklaren in termen van watermoleculen?
2 Hoe kunt u cohesie en hechting verklaren in termen van watermoleculen?  Hoeveel keer geconcentreerd is de concentratie waterstofionen in een oplossing met pH van 3 dan die 5?
Hoeveel keer geconcentreerd is de concentratie waterstofionen in een oplossing met pH van 3 dan die 5?  Berekening van het warmteverlies in een pijp
Berekening van het warmteverlies in een pijp Forensisch onderzoek bewijst dat textielvezels kunnen worden overgedragen tussen kleding zonder contact
Forensisch onderzoek bewijst dat textielvezels kunnen worden overgedragen tussen kleding zonder contact
 Hittegolven in de oceaan verwoesten dieren in het wild, erger om te komen
Hittegolven in de oceaan verwoesten dieren in het wild, erger om te komen Wat is de Forest Stewardship Council-certificering?
Wat is de Forest Stewardship Council-certificering?  Helft van wereldwijd gezuiverd afvalwater, tarieven in ontwikkelingslanden nog steeds achter
Helft van wereldwijd gezuiverd afvalwater, tarieven in ontwikkelingslanden nog steeds achter Hoes, krimpen, verbouwen? Methoden voor biologische bodembedekkers onderzocht voor onkruidbestrijding
Hoes, krimpen, verbouwen? Methoden voor biologische bodembedekkers onderzocht voor onkruidbestrijding Branden wekken kritiek op de biodiversiteit op de Zweedse bosbouwindustrie
Branden wekken kritiek op de biodiversiteit op de Zweedse bosbouwindustrie
Hoofdlijnen
- Endosperm -weefsel is uniek voor welke van deze groepen?
- Veren hebben hun eigen geuren, en roofdieren weten het
- Nieuwe studie laat zien hoe het Ebola-virus cellen infecteert
- Wetenschapsprojecten over Dominant en Recessieve Genen
- Hoe beschrijf je het cytoplasma?
- Wat zijn specifieke celtypen?
- Wat vormt de darmmicrobioom van de bruine beren in Alaska? Locatie, locatie, locatie
- Nieuw mechanisme wijst de weg naar het doorbreken van de antibioticaresistentie van ribosoom
- Waarom worden reuzenpanda’s zo klein geboren?
- Korrelig aluminium voor toekomstige computers
- De geheimen van Tennessee whisky ontrafelen

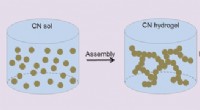
- Carbonitride-aerogels bemiddelen de fotokatalytische omzetting van water
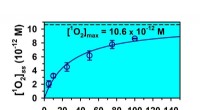
- Geabsorbeerde fotonen door 2-oxocarbonzuren omzetten in zeer reactieve singlet-zuurstof
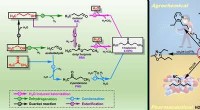
- Onderzoekers bevorderen het transformatieproces van biomassa
 Wat is de chemische samenstelling van paraffine?
Wat is de chemische samenstelling van paraffine?  Nugget the cow:Zeewier-kauwend rund kauwt op oplossing voor methaanprobleem
Nugget the cow:Zeewier-kauwend rund kauwt op oplossing voor methaanprobleem  Nieuwe wasmiddelen voor geneesmiddelenonderzoek
Nieuwe wasmiddelen voor geneesmiddelenonderzoek Wat zijn subscripts in een chemische formule die wordt gebruikt om aan te geven?
Wat zijn subscripts in een chemische formule die wordt gebruikt om aan te geven?  Wat zijn de voordelen van huisvliegen?
Wat zijn de voordelen van huisvliegen?  Investeringen in de autosector in het VK storten in door de impact van de Brexit:gegevens uit de sector
Investeringen in de autosector in het VK storten in door de impact van de Brexit:gegevens uit de sector Informatie voor kinderen over elektromagneten
Informatie voor kinderen over elektromagneten  Hoe is frisdrank dikker dan water?
Hoe is frisdrank dikker dan water?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

