
Wetenschap
Waarom drukken chemici vaak de zuurgraad van een oplossing uit als pH -waarde in plaats van geconcentreerd waterstofion?
1. Gemakkelijker te hanteren en te begrijpen: PH -waarden zijn meestal tussen 0 en 14, waardoor ze gemakkelijker te begrijpen en te onthouden zijn in vergelijking met waterstofionconcentraties, die vaak zeer kleine aantallen zijn (bijvoorbeeld 10⁻⁵ m).
2. Logaritmische schaal biedt een breder bereik: De pH -schaal is logaritmisch, wat betekent dat een verandering van één pH -eenheid een tienvoudige verandering in waterstofionconcentratie vertegenwoordigt. Dit zorgt ervoor dat een breder bereik van de zuurgraad compact wordt weergegeven, vergeleken met een lineaire schaal van waterstofionconcentratie die veel grotere aantallen zou vereisen.
3. Gemak en standaardisatie: Het gebruik van een gestandaardiseerde pH -schaal maakt een eenvoudige vergelijking van de zuurgraad van verschillende oplossingen mogelijk, ongeacht de specifieke concentratie van waterstofionen. Dit is cruciaal voor communicatie en begrip bij wetenschappers.
4. Praktische overwegingen: PH -meters zijn direct beschikbaar en kunnen pH -waarden gemakkelijk direct meten, waardoor het handig is voor experimenteel werk.
5. Menselijke perceptie: De menselijke tong is gevoelig voor veranderingen in zuurgraad, maar het is niet lineair. De pH -schaal komt beter overeen met de menselijke ervaring van zuurheid, waardoor het intuïtiever wordt voor begrip.
Samenvattend:
De pH -schaal biedt een handiger, begrijpelijker en praktische manier om de zuurgraad van een oplossing uit te drukken in vergelijking met waterstofionconcentratie. Het zorgt voor eenvoudiger vergelijking, communicatie en meting, waardoor het de voorkeursmethode voor chemici is.
Hoofdlijnen
- A T C G Wat zou de gratis mRNA -streng lezen?
- Hoe bijen hun baby's op natuurlijke wijze vaccineren
- Hoeveel onontdekte wezens zijn er in de oceaan?
- Wat is de fase in de mitose waarin het kernmembraan verdwijnt?
- Wat is wetenschappelijke notatie voor 420?
- Waarom spelen bacteriën een rol in de stikstofcyclus?
- Trechtervisie:nieuwe informatie over hoe cellen in het oog helpen licht naar het netvlies te geleiden
- Lijst van forensische technieken
- Moet je in een perfect gebonden en ongebroken tas bewijs zien van suikermoleculen die door het membraan gaan?
- Hydrogel-composiet ontwikkeld om beschermende uitrusting te helpen snel giftige zenuwgassen af te breken

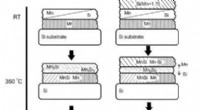
- Natuurkundigen houden toezicht op de vorming van hogere mangaansilicidefilms
- Video:Hoe dieren gloeien

- Gevriesdroogde aardbeien en ijs zorgen voor een zeer stabiele relatie

- E-nose kan verschillende muntgeuren onderscheiden

 Welke gassen vormen de zon?
Welke gassen vormen de zon?  Elektriciteitsprojecten voor 5e nivelleermachines
Elektriciteitsprojecten voor 5e nivelleermachines  De rol van algen in het ecosysteem
De rol van algen in het ecosysteem Welk type binding heeft N2?
Welk type binding heeft N2?  Hoeveel hemelse lichamen in het zonnestelsel?
Hoeveel hemelse lichamen in het zonnestelsel?  Planeten wiens banen dichter bij de zon liggen dan asteroïden?
Planeten wiens banen dichter bij de zon liggen dan asteroïden?  Wat is de pH van mierenzuur?
Wat is de pH van mierenzuur?  Hoe tieners er baat bij hebben 'verontrustende' boeken te kunnen lezen die sommigen willen verbieden
Hoe tieners er baat bij hebben 'verontrustende' boeken te kunnen lezen die sommigen willen verbieden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


