
Wetenschap
Welke van de volgende reacties toont dat de vorming SO2 296,8 kJ mol vrijgeeft?
Hier is de reactie die dit vertegenwoordigt:
s (s) + o₂ (g) → so₂ (g) ΔH ° F =-296,8 kJ/mol
Verklaring:
* s (s): Dit vertegenwoordigt vaste zwavel in zijn standaardtoestand.
* o₂ (g): Dit vertegenwoordigt zuurstofgas in zijn standaardtoestand.
* so₂ (g): Dit vertegenwoordigt zwaveldioxidegas, het product van de reactie.
* ΔH ° F =-296,8 kJ/mol: Dit geeft aan dat de standaard enthalpiewijziging voor de vorming van één mol van SO₂ uit zijn elementen in hun standaardstaten -296,8 kJ is. Het negatieve teken betekent dat de reactie exotherme is en warmte vrijgeeft.
Belangrijke opmerking: De enthalpie van formatie wordt altijd gedefinieerd voor de vorming van één mol van de verbinding uit zijn elementen in hun standaardstaten bij 298 K (25 ° C) en 1 atm druk.
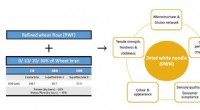
 Ingenieurs maken de basisbouwsteen voor elektrospun nanovezels
Ingenieurs maken de basisbouwsteen voor elektrospun nanovezels Wat is de oppervlakte in vierkante meters van 495 g Al-folie met een dikte van 29647 nm en een dichtheid van 2,70 gcm3?
Wat is de oppervlakte in vierkante meters van 495 g Al-folie met een dikte van 29647 nm en een dichtheid van 2,70 gcm3?  Nikkelferriet bevordert de capaciteit en cyclusstabiliteit van lithium-zwavelbatterijen
Nikkelferriet bevordert de capaciteit en cyclusstabiliteit van lithium-zwavelbatterijen Onderzoekers karakteriseren nauwkeurig styreenoxide-isomerase, dat zou kunnen helpen groene chemicaliën en medicijnprecursoren op te leveren
Onderzoekers karakteriseren nauwkeurig styreenoxide-isomerase, dat zou kunnen helpen groene chemicaliën en medicijnprecursoren op te leveren  Wat is de evenwichtige vergelijking voor dimethylether verbrand in lucht?
Wat is de evenwichtige vergelijking voor dimethylether verbrand in lucht?
 Bosbezoeken in Zwitserland getroffen door coronavirusvergrendeling
Bosbezoeken in Zwitserland getroffen door coronavirusvergrendeling Een punt van land dat in een lichaamswater reikt?
Een punt van land dat in een lichaamswater reikt?  NASA ontdekt dat tropische storm Jeruto zich ontwikkelt in de zuidelijke Indische Oceaan
NASA ontdekt dat tropische storm Jeruto zich ontwikkelt in de zuidelijke Indische Oceaan Wat biologische klokken en geologische rotsen ons vertellen over het leven in de ruimte
Wat biologische klokken en geologische rotsen ons vertellen over het leven in de ruimte Sea Kelp Feiten voor kinderen
Sea Kelp Feiten voor kinderen
Hoofdlijnen
- Wat is een radicale biologie?
- Wat is de diatomee -locomotie?
- Wat doet wetenschapper dagelijks?
- Wat moet waar zijn als prokaryoten zich door endosymbiose in eukaryoten ontwikkelen?
- Welk probleem zouden mensen hebben als ze geen fenylalaninehydroxylase gebruiken?
- Onderzoek toont aan dat commerciële oogst van brekende schildpadden leidt tot bevolkingsafname
- Waarom is water van levensbelang?
- Nieuw onderzoek laat zien hoe sommige kippen gestreepte veren kregen
- Wat is een dorsale wortel en wat voor soort neuron in deze structuur?
- Noedels verrijkt met voedingsvezels door geavanceerde technologie blijven lekker
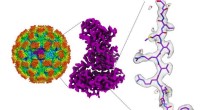
- Norovirusstructuren kunnen helpen bij het ontwikkelen van behandelingen voor voedselvergiftiging
- Een tool gebaseerd op het gebruik van koolstofnanodeeltjes maakt detectie van antidepressiva in urinemonsters mogelijk

- Onderzoekers ontwerpen nieuwe moleculen die de brandstofefficiëntie verhogen

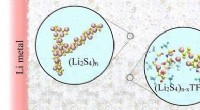
- Optimalisatie van de elektrolyten van lithium-zwavelbatterijen voor een lange levensduur
 Studie identificeert veilig toedieningssysteem voor lastige maar krachtige kankerbestrijdende stof
Studie identificeert veilig toedieningssysteem voor lastige maar krachtige kankerbestrijdende stof Geavanceerd viraal nanovaccin voor kankerimmunotherapie
Geavanceerd viraal nanovaccin voor kankerimmunotherapie Wat is de oorsprong van woordafval?
Wat is de oorsprong van woordafval?  Het potentieel van hoge houten gebouwen verkennen
Het potentieel van hoge houten gebouwen verkennen Wat is de juiste volgorde die begint bij het oppervlak van aardlagen?
Wat is de juiste volgorde die begint bij het oppervlak van aardlagen?  Wat is zwaarder - een kopje water bij kamertemperatuur of bevroren?
Wat is zwaarder - een kopje water bij kamertemperatuur of bevroren?  Zal meer sneeuw boven Antarctica de stijgende zeeën compenseren? Reken er niet op
Zal meer sneeuw boven Antarctica de stijgende zeeën compenseren? Reken er niet op  Een röntgenfoto van koolstof
Een röntgenfoto van koolstof
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

