
Wetenschap
Hoe wordt de oxidatietoestand van overgangsmetaal bepaald uit chemische formule?
1. Begrijp oxidatietoestanden
* Definitie: Oxidatietoestand (of oxidatienummer) is een hypothetische lading die een atoom zou hebben als al zijn obligaties 100% ionisch zouden zijn.
* regels:
* De oxidatietoestand van een vrij element (zoals NA, CL2, enz.) Is altijd 0.
* De som van oxidatietoestanden in een neutrale verbinding moet gelijk zijn aan 0.
* De som van oxidatietoestanden in een polyatomisch ion moet gelijk zijn aan de lading van het ion.
* Groep 1 metalen hebben een +1 oxidatietoestand.
* Groep 2 metalen hebben een +2 oxidatietoestand.
* Halogenen (groep 17) hebben meestal een -1 oxidatietoestand (behalve in verbindingen met zuurstof).
* Zuurstof heeft meestal een -2 oxidatietoestand (behalve in peroxiden, waar het -1 is).
2. Identificeer het overgangsmetaal
Overgangsmetalen worden gevonden in het D-blok van de periodiek systeem. Ze kunnen meerdere oxidatietoestanden hebben.
3. Analyseer de chemische formule
* Identificeer andere elementen: Bepaal de oxidatietoestanden van de andere elementen in de verbinding met behulp van de bovenstaande regels.
* Gebruik de som van oxidatietoestanden regel:
* Voor een neutrale verbinding:de som van de oxidatietoestanden van alle elementen moet nul gelijk zijn.
* Voor een polyatomisch ion:de som van de oxidatietoestanden van alle elementen moet gelijk zijn aan de lading van het ion.
4. Los voor de oxidatietoestand van het overgangsmetaal
Laat 'x' de oxidatietoestand van het overgangsmetaal vertegenwoordigen. Een vergelijking instellen:
(x * Aantal overgangsmetaalatomen) + (som van oxidatietoestanden van andere elementen) =0 (voor een neutrale verbinding)
OF
(x * aantal overgangsmetaalatomen) + (som van oxidatietoestanden van andere elementen) =lading van het ion (voor een polyatomisch ion)
Voorbeeld:bepaal de oxidatietoestand van ijzer in Fe2O3.
1. Identificeer het overgangsmetaal: IJzer (Fe)
2. Andere elementen: Zuurstof (O) heeft een oxidatietoestand van -2.
3. Stel de vergelijking in: (2 * x) + (3 * -2) =0
4. Oplossen voor x: 2x - 6 =0, 2x =6, x =+3
Daarom is de oxidatietoestand van ijzer in Fe2O3 +3.
belangrijke opmerkingen:
* Sommige overgangsmetalen hebben gemeenschappelijke oxidatietoestanden, maar het is altijd het beste om de regels te gebruiken om ze te berekenen.
* Soms kunnen overgangsmetalen meer dan één oxidatietoestand in dezelfde verbinding vertonen (bijvoorbeeld in gemengde valentieverbindingen). Deze gevallen vereisen meer complexe overwegingen.
 Supramoleculaire complexvorming - antraceen macrocyclus en C60 fullereen
Supramoleculaire complexvorming - antraceen macrocyclus en C60 fullereen Door microzwaartekracht gegroeide kristallen onthullen nieuwe inzichten in eiwitstructuren
Door microzwaartekracht gegroeide kristallen onthullen nieuwe inzichten in eiwitstructuren  Waar wordt de emissiespectrograaf voor gebruikt?
Waar wordt de emissiespectrograaf voor gebruikt?  Fluorescentiesonde toont de verdeling van actieve lithiumsoorten op lithiummetaalanoden
Fluorescentiesonde toont de verdeling van actieve lithiumsoorten op lithiummetaalanoden Een moleculaire blik op ontluikende HDL-vorming
Een moleculaire blik op ontluikende HDL-vorming
 Klimaat van moerasland-moeras Ecosystemen
Klimaat van moerasland-moeras Ecosystemen  Waren de oude Maya's een waarschuwend verhaal voor de landbouw? Misschien niet, suggereert een nieuwe studie
Waren de oude Maya's een waarschuwend verhaal voor de landbouw? Misschien niet, suggereert een nieuwe studie  Wat is de functie van eierstokken van bloemen?
Wat is de functie van eierstokken van bloemen?  Wat is de climax in het boek The Forest Hands and Teeth?
Wat is de climax in het boek The Forest Hands and Teeth?  Droogte in Europa zou vermeden kunnen worden door snellere emissiereducties
Droogte in Europa zou vermeden kunnen worden door snellere emissiereducties
Hoofdlijnen
- Wetenschappers leggen uit waarom de lange levensduur van naakte molratten in tegenspraak is met de geaccepteerde verouderingstheorie
- Wat is de wetenschappelijke methode?
- Wat is een onuitgesproken gen?
- Wat is niet een manier waarop celdeling de groeiproblemen oplost?
- Kunnen planten ontkiemen met heet water?
- Studie kijkt naar de invloed van woonwerven op voedselwebben
- Kwallenexperts tonen aan dat toegenomen bloei een gevolg is van periodieke mondiale schommelingen
- Wat wordt gebruikt om nieuwe genen in plantencellen in te voegen?
- Wat is een standaard DNA -grootte en waarom deze wordt gebruikt in gelelektroforese?
- Trifluorazijnzuur werkt als trifluormethyleringsmiddel bij de functionalisering van areen C-H
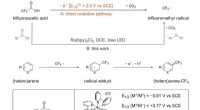
- Een moleculaire blik op ontluikende HDL-vorming

- Ontdekking van een ongebruikelijk eiwit

- Interactie tussen jodonium en zilverkation voor het eerst aangetoond
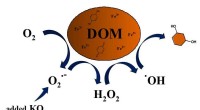
- Superoxide produceert hydroxylradicalen die opgeloste organische stoffen in water afbreken
 Wat zijn enkele fysieke eigenaardigheden van AlCL3?
Wat zijn enkele fysieke eigenaardigheden van AlCL3?  Onderzoekers bedenken zijwaartse benadering van 2D-hybride
Onderzoekers bedenken zijwaartse benadering van 2D-hybride Wanneer continenten convergeren welke structuur wordt gevormd?
Wanneer continenten convergeren welke structuur wordt gevormd?  Mariene vegetatie kan de verzuring van de oceaan tegengaan, studie vondsten
Mariene vegetatie kan de verzuring van de oceaan tegengaan, studie vondsten Ingrediënt in zeep kan de bevochtigbaarheid van uw huid veranderen
Ingrediënt in zeep kan de bevochtigbaarheid van uw huid veranderen Studie bevestigt de invloed van planetaire getijdenkrachten op zonneactiviteit
Studie bevestigt de invloed van planetaire getijdenkrachten op zonneactiviteit Waarom jonge mensen in Zuid-Korea vrijgezel blijven ondanks pogingen om te daten
Waarom jonge mensen in Zuid-Korea vrijgezel blijven ondanks pogingen om te daten Welk effect hebben organische fosfor inscticiden op levende organismen?
Welk effect hebben organische fosfor inscticiden op levende organismen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

