
Wetenschap
Door microzwaartekracht gegroeide kristallen onthullen nieuwe inzichten in eiwitstructuren
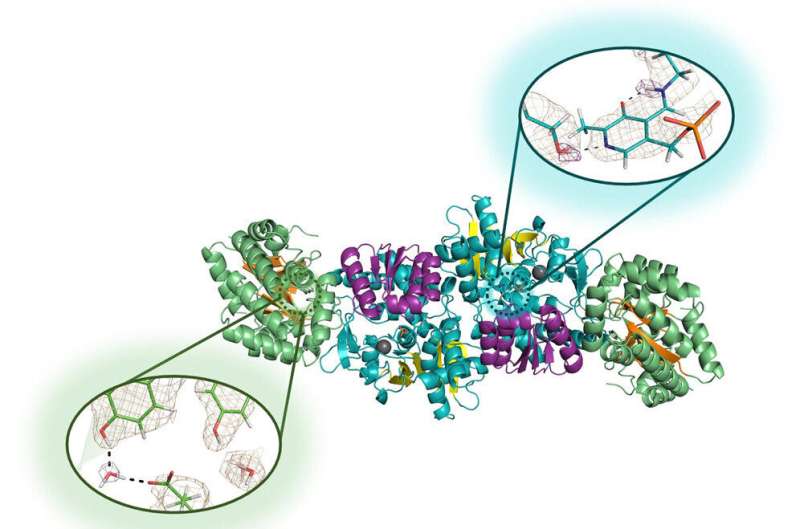
Biochemici werken al lange tijd rond een blinde vlek als het om eiwitten gaat. Ze weten dat waterstof bijna de helft van de atomen in eiwitten uitmaakt, maar hoe ze bijdragen aan de eiwitfunctie in deze complexe structuren is minder duidelijk. Waterstofatomen zijn zo klein dat traditionele structurele biologietechnieken hun posities niet kunnen onthullen.
"Dus je mist de helft van de informatie", zegt dr. Victoria Drago, een postdoctoraal onderzoeksmedewerker bij het Oak Ridge National Laboratory (ORNL) in Tennessee en recent alumna van de Universiteit van Toledo.
Het niet volledig kunnen bijhouden van de locaties van de waterstofatomen van een eiwit is een raadsel met implicaties die verder reiken dan het laboratorium, ook bij het ontwerpen van op structuur gebaseerde medicijnen.
Drago begon als afgestudeerde student naast Dr. Timothy Mueser, een professor aan de UToledo Department of Chemistry and Biochemistry, een techniek te onderzoeken om anders ongrijpbare waterstofatomen te lokaliseren, waarbij eiwitkristallen in microzwaartekracht moesten groeien.
De analyse van deze kristallen – een scheikundige term die in dit geval verwijst naar de precieze rangschikking van de samenstellende atomen en moleculen – vormt de basis van een onlangs gepubliceerd onderzoeksartikel in het tijdschrift Cell Reports Physical Science .
"We gebruikten neutronendiffractie", zegt Drago, de hoofdauteur van het artikel en die in 2022 afstudeerde met een doctoraat in de scheikunde. "We konden het experiment uitvoeren en een hoge resolutie bereiken door gebruik te maken van microzwaartekracht om kristallen van hoge kwaliteit te laten groeien. van het enzym."
Neutronendiffractie is een hightech proces waarmee onderzoekers de precieze locaties van elk afzonderlijk atoom van een molecuul in kaart kunnen brengen. Het werkt om de locaties van kleine waterstofatomen te identificeren, net als bij andere atomen, maar het signaal is extreem zwak in traditionele structurele biologietechnieken. Daarom hebben ze zich tot microzwaartekracht gewend, wat de groei van grotere en perfecter gestructureerde kristallen mogelijk maakt.

Drago, Mueser en hun medewerkers bij ORNL en Institut Laue-Langevin, een toonaangevende nucleaire onderzoeksfaciliteit in Grenoble, Frankrijk, stuurden oplossingen van het enzym tryptofaansynthase op voor een tour van een maand door het Internationale Ruimtestation in 2018, en opnieuw voor een reis van zes maanden van 2019 tot en met 2020. De tweede reis leverde verschillende zeer grote, perfecte kristallen op – waarvan vele ongeveer een kubieke millimeter, vijf keer zo groot als die onderzoekers in laboratoria groeiden – die meer dan 80 miljoen kilometer aflegden en een 9G-splashdown in de atmosfeer overleefden. Stille Oceaan.
Neutronendiffractie bleek succesvol op deze kristallen, waardoor de onderzoekers voor het eerst de waterstofatomen in de actieve plaats konden onthullen van het enzym dat ze wilden bestuderen.
Tryptofaansynthase is wetenschappelijk waardevol als vertegenwoordiger van een grote en zeer veelzijdige familie van enzymen die vitamine B6 gebruiken voor hun werking. Omdat mensen geen tryptofaansynthase produceren, is het ook aantrekkelijk voor medicijnontwerpers die geïnteresseerd zijn in het benutten van de chemische structuur van eiwitten bij de ontwikkeling van nieuwe verbindingen om pathogene micro-organismen zoals Salmonella enterica, Staphylococcus aureus en Mycobacterium tuberculosis te bestrijden.