
Wetenschap
Hoe zijn de emprische en moleculaire formularmen voor een samengestelde gerelateerde?
* Empirische formule: Vertegenwoordigt de eenvoudigste verhouding van het hele nummer van atomen in een verbinding. Het vertelt u het type atomen aanwezig en hun relatieve proporties.
* Moleculaire formule: Vertegenwoordigt het werkelijke aantal atomen van elk element in een molecuul van de verbinding.
Hier is de belangrijkste relatie:
* De moleculaire formule is altijd een veelvoud van de empirische formule.
Voorbeeld:
* Glucose:
* Empirische formule: Ch₂o (dit is de eenvoudigste verhouding tussen koolstof, waterstof en zuurstofatomen)
* Moleculaire formule: C₆h₁₂o₆ (dit is het werkelijke aantal atomen in een glucosemolecuul)
Om van empirische formule naar moleculaire formule te komen, heb je nodig:
1. De empirische formule: Dit vertelt u de basisatoomverhoudingen.
2. De molaire massa van de verbinding: Dit vertelt je de werkelijke massa van een molecuul.
Hier is hoe u de moleculaire formule kunt vinden:
1. Bereken de empirische formulemassa: Tel de atomaire massa's van de atomen in de empirische formule op.
2. Verdeel de molaire massa van de verbinding door de empirische formulemassa: Dit geeft u de multiplier van het hele nummer voor de empirische formule.
3. Vermenigvuldig de subscripts in de empirische formule door de multiplier: Dit geeft je de moleculaire formule.
Samenvattend:
* De empirische formule vertelt u het * type * en * relatieve nummer * van atomen in een verbinding.
* De moleculaire formule vertelt u het * werkelijke aantal * van atomen in een molecuul van de verbinding.
* De moleculaire formule is altijd een veelvoud van de empirische formule.
 Veranderende temperaturen helpen de maïsproductie in de VS - voorlopig
Veranderende temperaturen helpen de maïsproductie in de VS - voorlopig Waarom een keten van kleine eilanden in de Stille Oceaan een oordeel van de internationale rechtbank wil over de verantwoordelijkheid voor de klimaatcrisis
Waarom een keten van kleine eilanden in de Stille Oceaan een oordeel van de internationale rechtbank wil over de verantwoordelijkheid voor de klimaatcrisis  Hoe u erachter komt of uw land olie heeft
Hoe u erachter komt of uw land olie heeft Wat eet een eekhoorn in de voedselketen?
Wat eet een eekhoorn in de voedselketen?  Vijf klassen van chordaten
Vijf klassen van chordaten
Hoofdlijnen
- Hoe schrijf je de complementaire streng en mRNA voor atggacaaactcaactca?
- Nieuw onderzoek onthult hoe vleermuishersenen zijn georganiseerd voor echolocatie en vlucht
- Onderzoekers passen gist aan om te laten zien hoe planten reageren op een belangrijk hormoon
- De koala:wanneer het slim is om langzaam te zijn
- Beweging over het celmembraan mogelijk gemaakt door een eiwit ingebed in membraan?
- Uit welke xyleemcellen bestaat het grootste deel van hout?
- Wat is de studie van weefsels of groepencellen en hun extracellulaire materialen?
- UW-wetenschappers ontrafelen het mysterie van hoe griepvirussen zich vermenigvuldigen
- Orka's leren elkaar hoe ze vis kunnen stelen uit menselijke visserij
- Een nieuw elektrolytontwerp dat de prestaties van Li-ionbatterijen zou kunnen verbeteren
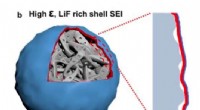
- Nieuw proces verkleint de kloof tussen natuurlijke en synthetische materialen

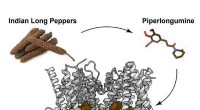
- Ingrediënt in Indiase lange peper veelbelovend tegen hersenkanker in diermodellen
- De uitdaging om koolstof op te vangen

- Een weg naar de toekomst, geplaveid met keramiek

 Wat zijn twee manieren om erosie te voorkomen of te vertragen?
Wat zijn twee manieren om erosie te voorkomen of te vertragen?  Onregelmatige online-handle geschikt voor Capital One hack verdachte
Onregelmatige online-handle geschikt voor Capital One hack verdachte Hoeveel menselijke chromosomen zijn zowel voor mannen als vrouwen gemeenschappelijk?
Hoeveel menselijke chromosomen zijn zowel voor mannen als vrouwen gemeenschappelijk?  Het heroverwegen van het ontwerp van digitale services kan hun impact op het milieu verminderen
Het heroverwegen van het ontwerp van digitale services kan hun impact op het milieu verminderen Nieuwe methode voor het 3D-printen van metaalopvangfilters om selectief edelmetalen te scheiden van afgedankte elektronische apparatuur
Nieuwe methode voor het 3D-printen van metaalopvangfilters om selectief edelmetalen te scheiden van afgedankte elektronische apparatuur Jongeren willen seksuele voorlichting en religie mag niet in de weg staan
Jongeren willen seksuele voorlichting en religie mag niet in de weg staan Windwijzer Feiten
Windwijzer Feiten  NASA's Webb Telescope schittert met Amerikaanse vindingrijkheid
NASA's Webb Telescope schittert met Amerikaanse vindingrijkheid
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

