
Wetenschap
Wat is de thermische aard van een reactie?
Exotherme reacties:
* Warmte vrijgeven in de omgeving.
* De producten hebben lagere energie dan de reactanten.
* De verandering in enthalpie (ΔH) is negatief .
* Voorbeelden:brandende brandstof, verbranding, neutralisatie van zuur en basis.
Endotherme reacties:
* Warmte absorberen uit de omgeving.
* De producten hebben hogere energie dan de reactanten.
* De verandering in enthalpie (ΔH) is positief .
* Voorbeelden:smeltend ijs, fotosynthese, het oplossen van ammoniumnitraat in water.
Key Concepts:
* Enthalpy (H) is een thermodynamische eigenschap die het totale warmtegehalte van een systeem vertegenwoordigt.
* Verandering in enthalpie (ΔH) is het verschil in enthalpie tussen producten en reactanten.
* Thermochemische vergelijkingen zijn evenwichtige chemische vergelijkingen die de enthalpie -verandering (ΔH) omvatten.
Hoe de thermische aard te bepalen:
1. Bekijk de temperatuurverandering: Als de omgeving heter wordt, is het exotherme. Als de omgeving kouder wordt, is deze endotherm.
2. Enthalpy Change (ΔH): Een negatieve AH duidt op een exotherme reactie, terwijl een positieve AH een endotherme reactie aangeeft.
Samenvattend:
De thermische aard van een reactie vertelt ons over de warmtestroom tijdens de reactie. Het is een belangrijk aspect van het begrijpen van chemische processen en hun impact op de omliggende omgeving.
 Wat beschrijft een isotoop het beste?
Wat beschrijft een isotoop het beste?  De C-H-bindingen in koolwaterstoffen verbreken om complexe organische moleculen te synthetiseren
De C-H-bindingen in koolwaterstoffen verbreken om complexe organische moleculen te synthetiseren Eiwitten vormgeven om chaperonne-gerelateerde ziekten te begrijpen
Eiwitten vormgeven om chaperonne-gerelateerde ziekten te begrijpen Wetenschappers ontwerpen ontdekking verdubbelt geleidbaarheid van indiumoxide transparante coatings
Wetenschappers ontwerpen ontdekking verdubbelt geleidbaarheid van indiumoxide transparante coatings Doorbraak in het bestuderen van het enzym dat uiteindelijk het visgeursyndroom veroorzaakt
Doorbraak in het bestuderen van het enzym dat uiteindelijk het visgeursyndroom veroorzaakt
 Scheuren in Arctisch zee-ijs zetten lage bewolking aan en uit
Scheuren in Arctisch zee-ijs zetten lage bewolking aan en uit Hoe de Stille Oceaan de langdurige droogte in het zuidwesten van de VS beïnvloedt
Hoe de Stille Oceaan de langdurige droogte in het zuidwesten van de VS beïnvloedt  Welke auto's van de wetenschap?
Welke auto's van de wetenschap?  Verveeld door fysiotherapie? Focus in plaats daarvan op burgerwetenschap
Verveeld door fysiotherapie? Focus in plaats daarvan op burgerwetenschap  Openhartige videoclips uit Thailand tonen inspanningen tegen stroperij om wilde dieren te redden
Openhartige videoclips uit Thailand tonen inspanningen tegen stroperij om wilde dieren te redden
Hoofdlijnen
- Verschil tussen lichaamscelmutatie en seksmutatie?
- Wat is de term voor uitwisseling van genetisch materiaal tussen bacteriën via contactpersonen?
- Heeft alle wetenschapstakken wetenschappelijke theorieën?
- Hoe reproduceert een lionfish zich?
- Welke organel is verantwoordelijk voor het aanzetten van energie naar de cel?
- Wie is verantwoordelijk voor het dubbele helixmodel?
- Beschrijf hoe veranderingen in het milieu gedragsfysiologische morfologische of adaptieve reacties in organismen kunnen veroorzaken?
- Nieuw onderzoek onthult aanwijzingen over hoe antilichamen verfijnd worden om infecties te bestrijden
- Wat zijn cellen met en zonder een kern genoemd?
- Nieuwe materialen voor de opslag van brandbare industriële gassen
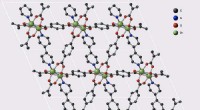
- Twee chirale katalysatoren die hand in hand werken

- Een bijgewerkt begrip van het synthetiseren van chemicaliën met toegevoegde waarde

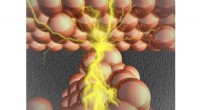
- De kloof op nanoschaal overbruggen:een diepe blik in atomaire schakelaars
- Pandemie biedt unieke kans voor atmosferische chemici

 Europese technologieleiders waarschuwen voor EU-belasting op digitale diensten
Europese technologieleiders waarschuwen voor EU-belasting op digitale diensten Studie onderzoekt hoe indianen zeeotters gebruikten
Studie onderzoekt hoe indianen zeeotters gebruikten  Schaamt u zich om technische ondersteuning te vragen? Je bent niet alleen
Schaamt u zich om technische ondersteuning te vragen? Je bent niet alleen  Onderzoekers patenteren een nanovloeistof die de warmtegeleiding verbetert
Onderzoekers patenteren een nanovloeistof die de warmtegeleiding verbetert Wat is de naam van een materiaal dat u kunt doorzien?
Wat is de naam van een materiaal dat u kunt doorzien?  Tetraëdrisch is de sleutel tot de uniciteit van water
Tetraëdrisch is de sleutel tot de uniciteit van water De nadelen van gelelektroforese
De nadelen van gelelektroforese  Welke voorzorgsmaatregelen neemt u tijdens het uitvoeren van een soortelijk gewichtstest?
Welke voorzorgsmaatregelen neemt u tijdens het uitvoeren van een soortelijk gewichtstest?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

