
Wetenschap
Hoe verschillen van stikstofisotopen van ionen?
isotopen van stikstof:
* Definitie: Isotopen zijn atomen van hetzelfde element (stikstof in dit geval) die hetzelfde aantal protonen (atoomnummer) hebben, maar verschillende aantallen neutronen. Dit betekent dat ze dezelfde chemische eigenschappen hebben, maar verschillende atoommassa's.
* Voorbeelden:
* stikstof-14 (¹⁴N): De meest voorkomende isotoop, met 7 protonen en 7 neutronen.
* stikstof-15 (¹⁵N): Een isotoop met 7 protonen en 8 neutronen.
* Key -kenmerken:
* Hetzelfde aantal protonen (definieert het element).
* Verschillende aantal neutronen (beïnvloedt atomaire massa).
* Identiek chemisch gedrag als gevolg van hetzelfde aantal elektronen.
ionen van stikstof:
* Definitie: Ionen zijn atomen of moleculen die elektronen hebben gewonnen of verloren, waardoor ze een netto elektrische lading hebben.
* Voorbeelden:
* stikstofkation (n⁺): Een stikstofatoom dat één elektron heeft verloren, wat resulteert in een +1 lading.
* nitride anion (n⁻³): Een stikstofatoom dat drie elektronen heeft opgedaan, wat resulteert in een lading van -3.
* Key -kenmerken:
* Hetzelfde aantal protonen (definieert het element).
* Hetzelfde aantal neutronen (tenzij het ion werd gevormd uit een isotoop).
* Verschillende aantal elektronen (geeft het ion zijn lading).
* Verschillende chemisch gedrag als gevolg van het verschillende aantal elektronen.
Samenvattend:
* isotopen Verschil in neutronennummer, wat leidt tot massavariaties.
* ionen verschillen in elektronennummer, wat leidt tot ladingsvariaties.
Key onderscheid: Isotopen zijn neutrale atomen, terwijl ionen geladen atomen of moleculen zijn. Het zijn verschillende concepten gerelateerd aan atomaire structuur en gedrag.
 Waterveiligheidscontroles onderschatten gevaarlijk de ziekteverwekkerniveaus, studie suggereert:
Waterveiligheidscontroles onderschatten gevaarlijk de ziekteverwekkerniveaus, studie suggereert: Nieuw-Zeelanders geloven in toenemende klimaatverandering
Nieuw-Zeelanders geloven in toenemende klimaatverandering Burgerwetenschappers kunnen een onbenutte hulpbron zijn voor verbetering van de waterkwaliteit
Burgerwetenschappers kunnen een onbenutte hulpbron zijn voor verbetering van de waterkwaliteit Onderzoek onthult een dieper wordende watercrisis in Jordanië - en een weg voorwaarts
Onderzoek onthult een dieper wordende watercrisis in Jordanië - en een weg voorwaarts Agrochemici vinden bewijs voor de ferro-wielhypothese
Agrochemici vinden bewijs voor de ferro-wielhypothese
Hoofdlijnen
- Vorm of functie? Evolutie volgt verschillende paden
- Hoe mosselen hun hechting onder water behouden
- Wat zijn voordelen van fotosynthese voor mensen in referentievoorbeelden?
- Onderzoekers onderzoeken effecten van tau-eiwitten op microtubuli in zenuwcellen
- Welke cellen kunnen niet delen na de geboorte bij mensen?
- Gebruikt een nucleotide eiwit?
- Hoe dragen pseudo-genen bij aan de evolutietheorie?
- Welke organellen hebben de bacteriecel en de plant gemeen?
- Nieuwe 'atlas' brengt in kaart hoe antilichamen spike-eiwitvarianten aanvallen
- Triangle 2 plastic containers kunnen een make-over voor het milieu ondergaan
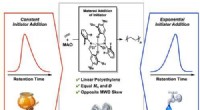
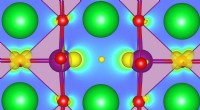
- Onderzoekers verbeteren de beschrijving van defecte oxiden met de eerste principes-berekening
- Chemici bevorderen het vermogen om chemische reacties te beheersen
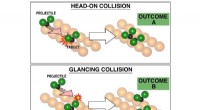
- Een oplossing aandrijven:professor neemt de leiding over het verbeteren van de veiligheid van lithium-ionbatterijen

- Katalysatorvervroeging verwijdert verontreinigende stoffen bij lage temperaturen

 Waar is wetenschappelijke metingen op gebaseerd?
Waar is wetenschappelijke metingen op gebaseerd?  Systemisch racisme heeft gevolgen voor al het leven in steden
Systemisch racisme heeft gevolgen voor al het leven in steden Verrassende bevindingen over bosbranden
Verrassende bevindingen over bosbranden Heetste gasreus ooit ontdekt, verdampt mogelijk tot de dood
Heetste gasreus ooit ontdekt, verdampt mogelijk tot de dood  Tijdens welke maanfasen is de zee van rust zichtbaar vanaf de aarde?
Tijdens welke maanfasen is de zee van rust zichtbaar vanaf de aarde?  Welk type cel maakt 10 procent de hersenen uit?
Welk type cel maakt 10 procent de hersenen uit?  Negatieve meningen aangenaam maken:uit onderzoek blijkt dat sociaal delen gebeurt in termen van ondersteuning
Negatieve meningen aangenaam maken:uit onderzoek blijkt dat sociaal delen gebeurt in termen van ondersteuning KeyBank:hackers van externe providers hebben klantgegevens gestolen
KeyBank:hackers van externe providers hebben klantgegevens gestolen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

