
Wetenschap
Hoeveel mol PCL5 kan worden geproduceerd uit 58,0 g CL2 (en overtollig P4)?
1. Evenwichtige chemische vergelijking
De evenwichtige chemische vergelijking voor de reactie is:
P₄ + 10 CL₂ → 4 PCL₅
2. Converteer gram van Cl₂ naar mol
* Zoek de molaire massa van Cl₂:2 * 35,45 g/mol =70,90 g/mol
* Deel de massa van CL₂ door zijn molaire massa:58,0 g / 70,90 g / mol =0,819 mol CL₂
3. Gebruik de molverhouding van de gebalanceerde vergelijking
* De vergelijking laat zien dat 10 mol CL₂ 4 mol PCL₅ produceert.
* Stel een aandeel in:(0,819 mol CL₂) / (10 mol CL₂) =(x mol pcl₅) / (4 mol pcl₅)
4. Oplossen voor x (mol pcl₅)
* Kruismultig:0,819 mol Cl₂ * 4 mol Pcl₅ =10 mol Cl₂ * x mol Pcl₅
* Los op voor x:x =(0,819 mol Cl₂ * 4 mol Pcl₅) / 10 mol CL₂
* Bereken:x =0,328 mol Pcl₅
Antwoord: 0,328 mol PCL₅ kan worden geproduceerd uit 58,0 g CL₂.
 Wat is de reactie van natrium en broom?
Wat is de reactie van natrium en broom?  Nieuwe verbindingen zijn veelbelovend in de strijd tegen tuberculose en neurodegeneratieve ziekten
Nieuwe verbindingen zijn veelbelovend in de strijd tegen tuberculose en neurodegeneratieve ziekten  Chemici gebruiken gemodificeerde DNA-nucleotiden om nieuwe materialen te maken
Chemici gebruiken gemodificeerde DNA-nucleotiden om nieuwe materialen te maken Na een eeuw zoeken, wetenschappers vinden nieuwe vloeibare fase
Na een eeuw zoeken, wetenschappers vinden nieuwe vloeibare fase Hoe wordt het aantal elektronen in de buitenste schil genoemd?
Hoe wordt het aantal elektronen in de buitenste schil genoemd?
 Natuurspektakel:een Denali-gletsjer snelt bergafwaarts, mogelijke hinder voor klimmers en vergroot overstromingsrisico
Natuurspektakel:een Denali-gletsjer snelt bergafwaarts, mogelijke hinder voor klimmers en vergroot overstromingsrisico Heeft de oogst van biomassa gevolgen voor de natuur?
Heeft de oogst van biomassa gevolgen voor de natuur?  Alomtegenwoordig marien organisme dat samen met andere microben is geëvolueerd, bevordering van complexere ecosystemen
Alomtegenwoordig marien organisme dat samen met andere microben is geëvolueerd, bevordering van complexere ecosystemen Het redden van bossen in Amerika kan helpen de klimaatopwarming te beteugelen
Het redden van bossen in Amerika kan helpen de klimaatopwarming te beteugelen Wetlands zullen de zeespiegelstijging bijhouden om klimaatverandering te compenseren
Wetlands zullen de zeespiegelstijging bijhouden om klimaatverandering te compenseren
Hoofdlijnen
- Zijn gras- en fruit levende organismen?
- Wie zijn de Nebateeërs?
- Een ingenieursgids voor het embryo
- Wat gebeurt er met de nucleaire envelop tijdens cytokinese?
Cytokinese is de verdeling van één cel in twee en is de laatste stap na de mitotische celcyclus in vier stadia. Tijdens cytokinese blijft de nucleaire envelop, of kernmembraan, die het gen
- Toekomstige klimaateffecten brengen het bultrugdieet in gevaar
- Waarom evolueerden mensen een weerstand tegen de verkoudheid?
- Nieuwe structuren bieden inzicht in hoe een bacteriële motor bacteriële chemotaxis aandrijft, een belangrijk infectieus proces
- Hoe hersenspoeling werkt
- Studie:Grote witte haaien zwemmen steeds dieper
- Naar een stamcelmodel van de ontwikkeling van het menselijk zenuwstelsel
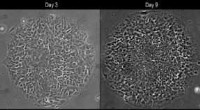
- Bioplastic gemaakt van nanocellulose en mango om het bewaren van voedsel te verbeteren

- Ontketenen van perovskietenpotentieel voor zonnecellen

- Nieuwe techniek bouwt superharde metalen uit nanodeeltjes
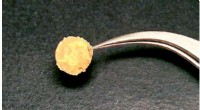
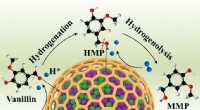
- Ingekapselde nanodeeltjes van NiCo-legeringen die HDO-reacties katalyseren
 Meer wolfachtig worden is de sleutel tot de toekomst voor coyotes
Meer wolfachtig worden is de sleutel tot de toekomst voor coyotes Hoeveel zuurstofatomen doet houtalcohol?
Hoeveel zuurstofatomen doet houtalcohol?  Verhoogt of verlaagt de temperatuur van vaste stof naar gas?
Verhoogt of verlaagt de temperatuur van vaste stof naar gas?  Facebook heeft regulering nodig - hier is waarom het moet worden gedaan door algoritmen
Facebook heeft regulering nodig - hier is waarom het moet worden gedaan door algoritmen NASA's Arctische ecosysteem wetenschapsvluchten beginnen
NASA's Arctische ecosysteem wetenschapsvluchten beginnen Wat stoot een heet waterstofgas uit?
Wat stoot een heet waterstofgas uit?  Onderzoekers ontdekken dat het microbiële profiel van het oppervlak van ruimtestations lijkt op de huid van de bemanningsleden
Onderzoekers ontdekken dat het microbiële profiel van het oppervlak van ruimtestations lijkt op de huid van de bemanningsleden Wat weerhoudt vrouwen ervan seksuele intimidatie te melden?
Wat weerhoudt vrouwen ervan seksuele intimidatie te melden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

