
Wetenschap
Waarom geometrie van H2O is niet lineair, terwijl CO2 lineair is?
Water (H₂o):
* Hybridisatie: Het zuurstofatoom in water ondergaat SP³ hybridisatie. Dit betekent dat de vier elektronenparen (twee bindingsparen en twee eenzame paren) zijn gerangschikt in een tetraëdrische geometrie.
* eenzame paar afstoting: De twee enige paren op het zuurstofatoom oefenen een sterkere weerzinwekkende kracht uit dan de bindingsparen. Dit duwt de twee waterstofatomen dichter bij elkaar, wat resulteert in een gebogen of V-vormige moleculaire geometrie.
* bindingshoek: De H-O-H-bindingshoek in water is ongeveer 104,5 °, die aanzienlijk afwijkt van de hoek van 180 ° van een lineair molecuul.
Koolstofdioxide (CO₂):
* Hybridisatie: Het koolstofatoom in koolstofdioxide ondergaat SP -hybridisatie. Dit betekent dat de twee elektronenparen (beide bindingsparen) lineair zijn gerangschikt.
* Geen eenzame paren: Koolstof heeft geen eenzame paren, dus er is geen afstoting om de lineaire opstelling te vervormen.
* bindingshoek: De O-C-O-bindingshoek in koolstofdioxide is 180 °, wat resulteert in een perfect lineair molecuul.
Samenvattend:
Het verschil in geometrie komt voort uit de aanwezigheid van alleenstaande paren op het zuurstofatoom in water. Deze alleenstaande paren creëren een sterkere afstoting dan de bindingsparen, waardoor het molecuul in een gebogen vorm wordt gedwongen. Koolstofdioxide, zonder eenzame paren op het centrale koolstofatoom, handhaaft een lineaire structuur.
 Wat is objectieve literatuurtheorie?
Wat is objectieve literatuurtheorie?  NASA analyseert waterdampconcentratie van tropische cycloon Herolds
NASA analyseert waterdampconcentratie van tropische cycloon Herolds Amerikaanse milieugroeperingen dienen een rechtszaak in om nieuwe mijnbouw op openbare gronden te blokkeren
Amerikaanse milieugroeperingen dienen een rechtszaak in om nieuwe mijnbouw op openbare gronden te blokkeren Kooldioxide-emissies van wereldwijde visserijen groter dan eerder gedacht
Kooldioxide-emissies van wereldwijde visserijen groter dan eerder gedacht Om meren gezond te maken, je hebt eerst het juiste recept nodig
Om meren gezond te maken, je hebt eerst het juiste recept nodig
Hoofdlijnen
- Wat is een organel in het cytoplasma dat energie voor cel levert?
- Wat gebeurt er tussen de twee lichaamssystemen voor ademhaling om in cellen te plaatsvinden?
- Wie heeft de wetenschappelijke basis van vaccinatie vastgesteld?
- Zijn eicellen bij ouder wordende primaten beschermd tegen mutaties?
- Hoe heet het proces waarbij een bacteriële cel DNA opneemt dat door anderen wordt vrijgegeven?
- Wat zijn vijf transportmechanisme waar door metabolieten voedingsstof of ionen het celmembraan oversteken?
- Wanneer een wetenschapper zijn of haar bevindingen deelt met andere wetenschappers?
- De chemische stof die planten vertelt wanneer het tijd is om te slapen
- Wat zijn de functies van longblaasjes in de longen?
- CO-biosynthese vereist voor de assemblage van de actieve plaats in NiFe-hydrogenase
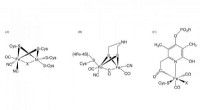
- Een duurzame nieuwe oplossing voor veroudering, corrosieve infrastructuur

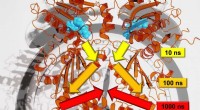
- Onderzoekers onderzoeken signaaloverdracht in eiwitten over meerdere tijdschalen
- Op jacht naar giftige stoffen in slib

- Een methode om afgebroken perovskiet in zonnecellen te vervangen door ze recyclebaar te maken

 Niet genoeg fruit, groenten geteeld om de planeet te voeden, studie onthult
Niet genoeg fruit, groenten geteeld om de planeet te voeden, studie onthult Het verschil tussen silicaat- en niet-silicaatmineralen
Het verschil tussen silicaat- en niet-silicaatmineralen  Hoe zou u veranderingen in fysische en chemische eigenschappen vergelijken?
Hoe zou u veranderingen in fysische en chemische eigenschappen vergelijken?  De dijken van New Orleans worden zwaar op de proef gesteld terwijl de storm losbarst
De dijken van New Orleans worden zwaar op de proef gesteld terwijl de storm losbarst Een frisse benadering van experimenteel ontwerp bij de SLAC-röntgenlaser
Een frisse benadering van experimenteel ontwerp bij de SLAC-röntgenlaser Geen verliezen:wetenschappers vullen grafeen met licht
Geen verliezen:wetenschappers vullen grafeen met licht Hoe een smalspectrumantibioticum zich richt op C. difficile
Hoe een smalspectrumantibioticum zich richt op C. difficile  Zou een sferische protist of cilindrische een hoger oppervlak tot volumeverhouding hebben?
Zou een sferische protist of cilindrische een hoger oppervlak tot volumeverhouding hebben?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

