
Wetenschap
CO-biosynthese vereist voor de assemblage van de actieve plaats in NiFe-hydrogenase
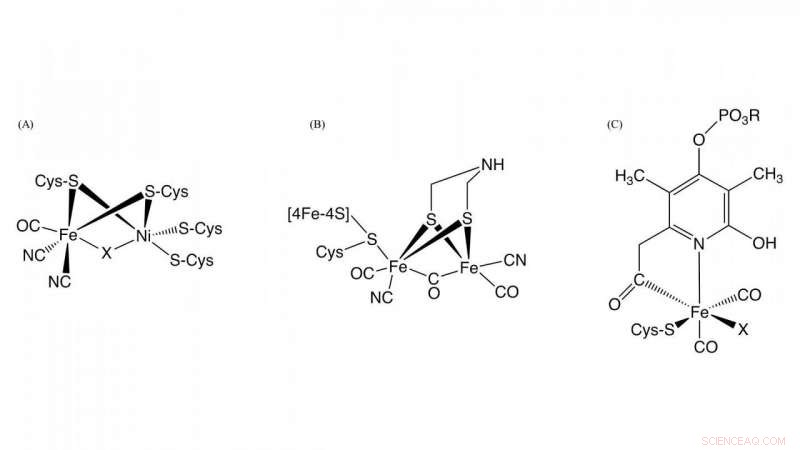
Figuur 1. Structuur van de actieve plaatsen in [NiFe]-hydrogenase, [FeFe]-hydrogenase, en [Fe]-hydrogenase Krediet:NINS/IMS
Een onderzoeksgroep met onderzoekers van het Exploratory Research Centre on Life and Living Systems (ExCELLS), Instituut voor Moleculaire Wetenschappen (IMS) in National Institutes of Natural Sciences, en de Universiteit van Osaka hebben het gedetailleerde mechanisme onthuld van de biosynthese van koolmonoxide die essentieel is voor de rijping van de actieve plaats van NiFe-hydrogenase.
Hydrogenase, dat is een metallo-enzym dat verantwoordelijk is voor de oxidatie van waterstofgas en de reductie van protonen, speelt een sleutelrol in het bacteriële waterstofmetabolisme. Op basis van de verschillen in metaalgehalte op de actieve site, ze zijn ingedeeld in drie groepen:NiFe-, FeFe-, en Fe-hydrogenasen die verschillende metaalcomplexen bevatten als actieve centra in deze enzymen (Figuur 1). Hoewel de structuren in de actieve centra ervan verschillend zijn, het is essentieel voor hydrogenase-activiteit dat koolmonoxide (CO) wordt gecoördineerd met het ijzerion in het actieve centrum. Het is bekend dat CO wordt gebiosynthetiseerd door een enzymatische reactie, maar het detail van CO-biosynthese was onbekend.
In dit onderzoek, de groep bepaalde de kristalstructuur van het enzym (HypX) dat verantwoordelijk is voor de biosynthese van CO (Figuur 2), op basis waarvan HypX CO biosynthetiseert door een ongekende reactie voor de rijping van NiFe-hydrogenase. HypX bestaat uit twee domeinen:de N-terminale en C-terminale domeinen. Een continue holte die de N- en C-terminale domeinen verbindt, is aanwezig in het interieur van HypX (Figuur 2). In de kristalstructuur, co-enzym A (CoA) is gebonden aan het C-terminale gebied van de holte.
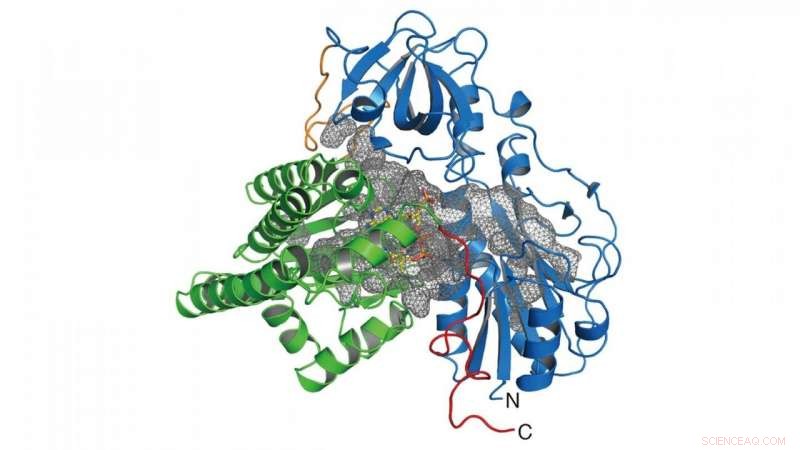
Figuur 2. Kristalstructuur van HypX. De N- en C-terminale domeinen worden weergegeven in blauw en groen, respectievelijk. De holte binnenin HypX wordt weergegeven in een grijs gaas. Krediet:NINS/IMS
Er vinden twee verschillende reacties plaats in de N- en C-terminale domeinen. In het N-terminale domein, een formylgroepoverdrachtsreactie van formyltetrahydrofolaat, die in het N-terminale gebied van de holte als een substraat aan CoA is gebonden, vindt plaats (reactiestap 1 in Fig. 3). Momenteel, CoA in de holte neemt de lineaire uitgebreide conformatie aan, en de SH-groep van CoA bevindt zich nabij de formylgroep in het formyltetrahydrofolaat gebonden in het N-terminale domein. Vervolgens, formyl-CoA wordt geproduceerd als een reactietussenproduct door de formylgroepoverdrachtsreactie van formyltetrahydrofolaat naar CoA.
In de volgende stap, formyl-CoA ondergaat een grote conformationele verandering in de holte zodat de formylgroep in de terminale positie van formyl-CoA zich op de actieve plaats in het C-terminale domein van HypX bevindt (reactiestap 2 in Fig. 3). In het C-terminale domein, CO wordt gevormd door decarbonylering van formyl-CoA (reactiestap 3 in Fig. 3).
Deze CO-biosynthesereactie is de ongekende en nieuwe reactie. CoA staat bekend als een co-enzym, die de belangrijke rol speelt in het vetzuurmetabolisme en het cellulaire energetische metabolisme door de citroenzuurcyclus. Echter, er is nooit gerapporteerd dat CoA/formyl-CoA betrokken is bij CO-biosynthesereacties. Dit onderzoek heeft een nieuwe fysiologische functie van een bekend co-enzym CoA aan het licht gebracht.
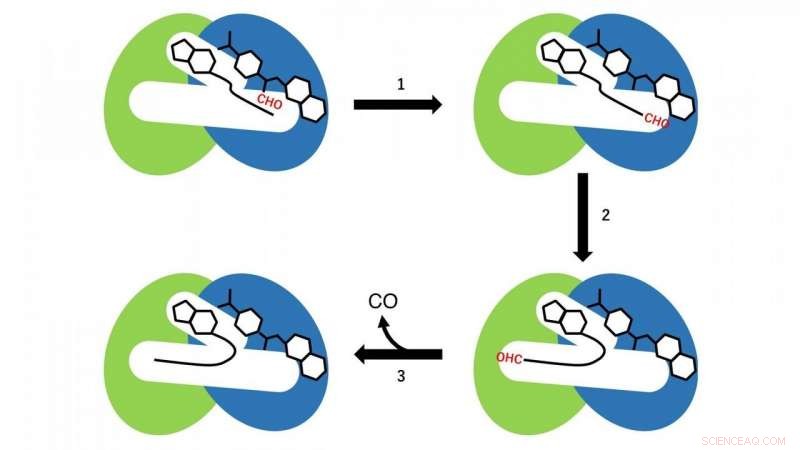
Figuur 3. Reactieschema van CO-biosynthese door HypX. De N- en C-terminale domeinen worden respectievelijk in blauw en groen weergegeven. Formyl-groep (CHO) wordt in het rood weergegeven. Krediet:NINS/IMS
Toekomstperspectieven:
De biosynthetische mechanismen van metallo-enzymen blijven in veel gevallen onbekend. Het moet nog worden opgehelderd, vooral hoe de metaalbevattende actieve centra van metallo-enzymen zijn samengesteld. In dit werk, we hebben de eerste kristalstructuur bepaald van het enzym dat de biosynthetische reactie van koolmonoxide katalyseert die essentieel is voor de constructie van de actieve plaats van [NiFe]-hydrogenase. In de toekomst, we zullen het onderzoek voortzetten voor het ophelderen van het gedetailleerde mechanisme van de hele hydrogenase-rijpingsroute op basis van dit resultaat.
 Welke isotoop wordt gebruikt om de schildklier te bestuderen?
Welke isotoop wordt gebruikt om de schildklier te bestuderen?  Priming-effect veroorzaakt door wortelafval varieert met de wortelvolgorde
Priming-effect veroorzaakt door wortelafval varieert met de wortelvolgorde Een vleugje goud stuurt kristallen elektrisch van opwinding
Een vleugje goud stuurt kristallen elektrisch van opwinding Nieuwe methode voor het labelen van DNA-basen voor sequencing
Nieuwe methode voor het labelen van DNA-basen voor sequencing Hoe de Ph of Water te berekenen met behulp van pKa
Hoe de Ph of Water te berekenen met behulp van pKa
 VN-rapport over klimaatverandering:landopruiming en landbouw dragen een derde van de broeikasgassen ter wereld bij
VN-rapport over klimaatverandering:landopruiming en landbouw dragen een derde van de broeikasgassen ter wereld bij Insecten die op bedwantsen lijken
Insecten die op bedwantsen lijken  Wetenschappers graven diep om de steeds veranderende grondwatervoorziening van Californië op te sporen
Wetenschappers graven diep om de steeds veranderende grondwatervoorziening van Californië op te sporen Mangroven beschermen kustlijnen, koolstof opslaan - en uitbreiden met klimaatverandering
Mangroven beschermen kustlijnen, koolstof opslaan - en uitbreiden met klimaatverandering Kan de zonne-energie worden gebruikt om water schoon te maken?
Kan de zonne-energie worden gebruikt om water schoon te maken?
Hoofdlijnen
- Maak kennis met de oudste dierlijke afstamming van Madagascar, een draaimolenkever met een 206 miljoen jaar oude oorsprong
- Urban Coopers-haviken overtreffen hun landelijke buren
- Kun je iemand echt doodsbang maken?
- Heeft een virus DNA?
- Welke bijdrage heeft Avery geleverd aan de ontdekking van DNA?
- Hoe de delen van de menselijke schedel te leren
- Wat doet ons gapen?
- 10 soorten studievooroordelen
- Factoren die de groei van micro-organismen beïnvloeden
- Onderzoekers gebruiken 3D-printen om kennis over microbiële gemeenschappen te vergroten

- Bewerkt plantaardig toxine bezit anti-tumor eigenschappen
- Plantaardige eiwitten uitdrogen met de snelheid van het geluid

- Hoe beïnvloedt het veranderen van de temperatuur de viscositeit en oppervlaktespanning van een vloeistof?

- Simulaties laten zien hoe atomen zich gedragen in zelfherstellend cement

 Blue Origin lanceert artwork, maanlandingstest in de ruimte
Blue Origin lanceert artwork, maanlandingstest in de ruimte Dubbele bubbels doorboren met minder moeite
Dubbele bubbels doorboren met minder moeite Wetenschappers gebruiken anorganische ingrediënten om defecten aan perovskietzonnecellen te beperken, efficiëntie behouden
Wetenschappers gebruiken anorganische ingrediënten om defecten aan perovskietzonnecellen te beperken, efficiëntie behouden Het mogelijke gebruik van deze 'tweede huid' is behoorlijk verbazingwekkend
Het mogelijke gebruik van deze 'tweede huid' is behoorlijk verbazingwekkend  Over vloeibare zuurstof
Over vloeibare zuurstof  Vlucht na de Koude Oorlog
Vlucht na de Koude Oorlog  Uit onderzoek blijkt dat de fijne structuurconstante van kwantumspin-ijs groot is
Uit onderzoek blijkt dat de fijne structuurconstante van kwantumspin-ijs groot is Interculturele communicatie cruciaal voor technisch onderwijs
Interculturele communicatie cruciaal voor technisch onderwijs
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Norway | French | Danish |

-
Wetenschap © https://nl.scienceaq.com

