
Wetenschap
Welke eigenschappen hebben alle niet -metalen gemeen?
Fysieke eigenschappen:
* Slechte warmtegeleiders van warmte en elektriciteit: Ze weerstaan de stroom van warmte en elektriciteit, waardoor ze goede isolatoren zijn.
* bros: Ze hebben de neiging gemakkelijk te breken in plaats van buigen of vervormen.
* Doffe uiterlijk: Ze missen het glanzende glans kenmerk van metalen.
* gassen of vloeistoffen bij kamertemperatuur: De meeste niet -metalen bestaan als gassen (zoals zuurstof en stikstof) of vloeistoffen (zoals broom), terwijl slechts enkele vaste stoffen zijn (zoals zwavel en koolstof).
* Lage dichtheid: Ze zijn over het algemeen minder dicht dan metalen.
chemische eigenschappen:
* Hoge elektronegativiteit: Ze hebben de neiging elektronen aan te trekken in chemische bindingen.
* Krijg gemakkelijk elektronen: Ze vormen anionen (negatief geladen ionen) wanneer ze reageren met metalen.
* Vorm covalente bindingen: Ze delen meestal elektronen met andere niet -metalen om moleculen te vormen.
* reageren met metalen om zouten te vormen: Natrium (een metaal) reageert bijvoorbeeld met chloor (een niet -metaal) om tafelzout (NaCl) te vormen.
* gevonden in verschillende staten: Ze bestaan in verschillende vormen zoals diatomaire moleculen (zoals O2), polyatomische moleculen (zoals CO2) en netwerken (zoals diamant).
Uitzonderingen:
Het is belangrijk op te merken dat hoewel deze eigenschappen de meeste niet -metalen gemeen hebben, er enkele uitzonderingen zijn. Grafiet (een vorm van koolstof) is bijvoorbeeld een goede geleider van elektriciteit.
Voorbeelden van niet -metalen:
* Zuurstof (O)
* Stikstof (n)
* Koolstof (C)
* Zwavel (s)
* Fosfor (p)
* Chloor (CL)
* Bromine (Br)
* Jodium (i)
Deze gedeelde eigenschappen maken niet -metalen verschillend van metalen en spelen een cruciale rol in hun chemische gedrag en toepassingen.
 Wanneer een gas wordt afgekoeld en vloeibaar wordt?
Wanneer een gas wordt afgekoeld en vloeibaar wordt?  Atomen omzetten in grammen
Atomen omzetten in grammen De zelfkoppelende eigenschap van koolstof wordt genoemd als?
De zelfkoppelende eigenschap van koolstof wordt genoemd als?  Twee voordelen van het gebruik van modellen om wetenschappelijke processen te vertegenwoordigen
Twee voordelen van het gebruik van modellen om wetenschappelijke processen te vertegenwoordigen Hoe verhoudt de eigenschappen van ijzer alleen vergeleken met in onverwarmde ijzer-zwavelcombinatie?
Hoe verhoudt de eigenschappen van ijzer alleen vergeleken met in onverwarmde ijzer-zwavelcombinatie?
 Hoe het gebruik van chemicaliën en het verlies aan biodiversiteit met elkaar verbonden zijn
Hoe het gebruik van chemicaliën en het verlies aan biodiversiteit met elkaar verbonden zijn  Grote branden vragen om een grote reactie:lessen uit de Big Burn uit 1910
Grote branden vragen om een grote reactie:lessen uit de Big Burn uit 1910 NASA vindt de sterkste stormen van Harvey
NASA vindt de sterkste stormen van Harvey Het klimaat van China in 2019:warmer en natter, maar minder verlies
Het klimaat van China in 2019:warmer en natter, maar minder verlies Rusland ziet recordhoge gemiddelde temperaturen in 2020
Rusland ziet recordhoge gemiddelde temperaturen in 2020
Hoofdlijnen
- Wat zijn enkele overeenkomsten tussen fenotype en genotype?
- Waarom is diffusie belangrijk voor het leven van een cel?
- Wanneer zijn dinosauriërs uitgestorven? De theorieën over hoe het gebeurde en wat overleefde
- Bestuiving is een reproductieve vooruitgang die wordt aangetroffen in angiospermplanten en wordt ondersteund door grote kleurrijke bloemen?
- Soorten microscopen en hun functies?
- De ontdekking van hoe stamcelniche differentiatie naar functionele cellen begeleidt, is een belangrijke stap in de richting van therapieën
- Zal het hernoemen van karperkopieën helpen om ze onder controle te krijgen?
- Wat is een Golgi-apparaat?
- Kip van de zee? De tonijnteelt krijgt een impuls
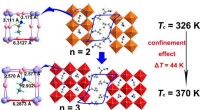
- Onderzoekers verwerven gelaagde metaalhalogenide-ferro-elektriciteit met hoge Curie-temperatuur via kooi-begrensde ethylaminerotators
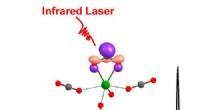
- Wetenschappers identificeren overgangsmetaal voor zeer efficiënte kooldioxide-activering
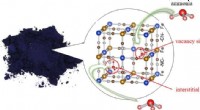
- Een blauw pigment dat een hoogwaardig ammoniakadsorbens blijkt te zijn
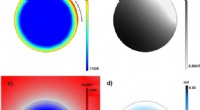
- Ontwikkeling van een 3D-deeltjesmodel voor afzonderlijke deeltjes in batterij-elektroden
- Geheim van Britse chocoladeproductie inspireert ontdekking van nieuwe lactosevorm

 Een boxplot-diagram maken
Een boxplot-diagram maken  Nieuwe verkeersregels in Graphene City
Nieuwe verkeersregels in Graphene City Studie wijst op nieuw wapen in strijd tegen dodelijke schimmels
Studie wijst op nieuw wapen in strijd tegen dodelijke schimmels Vuilnisverzamelende aqua-drones en kwallenfilters voor schonere oceanen
Vuilnisverzamelende aqua-drones en kwallenfilters voor schonere oceanen Move over, 'Laurel of Yanny':Studie onderzoekt waarom we praten als zingen horen na vele herhalingen
Move over, 'Laurel of Yanny':Studie onderzoekt waarom we praten als zingen horen na vele herhalingen  Onderzoekers gebruiken videogames om nieuwe niveaus van AI te ontgrendelen
Onderzoekers gebruiken videogames om nieuwe niveaus van AI te ontgrendelen Is kunstmatige selectie een agent van evolutionaire verandering?
Is kunstmatige selectie een agent van evolutionaire verandering?  Ariane 5-raket brengt Europese GPS-satellieten in een baan om de aarde (update)
Ariane 5-raket brengt Europese GPS-satellieten in een baan om de aarde (update)
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

