
Wetenschap
Waarom smelt zout ijs het snelst?
* Freezing Point Depression: Wanneer zout aan water wordt toegevoegd, lost het op en creëert het een oplossing. Deze oplossing heeft een lager vriespunt dan zuiver water. Zuiver water bevriest bij 32 ° F (0 ° C), maar de zoutoplossing zal bij een lagere temperatuur bevriezen, afhankelijk van de zoutconcentratie.
* IJs smelten: Wanneer zout op ijs wordt besprenkeld, lost het op in de dunne laag vloeibaar water dat zich natuurlijk op het oppervlak van het ijs vormt. Dit creëert een zoute oplossing met een lager vriespunt. Het ijs in contact met deze oplossing zal smelten omdat de temperatuur van de oplossing boven het nieuwe vriespunt ligt.
* De cyclus gaat verder: Naarmate het ijs smelt, mengt meer water zich met het zout, waardoor de oplossing nog meer geconcentreerd is en het vriespunt verder verlaagt. Dit proces gaat door totdat al het ijs smelt of de zoutconcentratie een punt bereikt waar het het vriespunt niet langer genoeg kan verlagen om het resterende ijs te smelten.
Andere factoren:
* Type zout: Verschillende zouten hebben verschillende effecten op het vriespunt van water. Natriumchloride (tafelzout) wordt vaak gebruikt, maar andere zouten zoals calciumchloride zijn effectiever bij het verlagen van het vriespunt.
* Temperatuur: De effectiviteit van zout in smeltend ijs hangt af van de omgevingstemperatuur. Zout is effectiever bij smeltend ijs bij temperaturen boven 15 ° F (-9 ° C). Onder die temperatuur wordt zout minder effectief.
Samenvattend: Zout smelt ijs niet direct, maar het verlaagt het vriespunt van water, waardoor het ijs smelt bij temperaturen onder het normale vriespunt.
 Als het leven tegen zit, bioplastic maken
Als het leven tegen zit, bioplastic maken Hoe stapelen chloorfluorkoolwaterstoffen zich op in de atmosfeer?
Hoe stapelen chloorfluorkoolwaterstoffen zich op in de atmosfeer?  Weten hoe bacteriën afval verwijderen, kan leiden tot nieuwe antibiotica
Weten hoe bacteriën afval verwijderen, kan leiden tot nieuwe antibiotica  Een nieuwe methode om zwavel in complexe moleculen te installeren
Een nieuwe methode om zwavel in complexe moleculen te installeren Hoe verschilt een neutralisatiereactie van een typische dubbele verdringingsreactie?
Hoe verschilt een neutralisatiereactie van een typische dubbele verdringingsreactie?
 Hoe te combineren Vasculaire en niet-vasculaire planten
Hoe te combineren Vasculaire en niet-vasculaire planten Uit onderzoek blijkt dat er een enorme hoeveelheid mondiale bodemkoolstof is opgeslagen
Uit onderzoek blijkt dat er een enorme hoeveelheid mondiale bodemkoolstof is opgeslagen  Duizenden tonnen e-waste worden illegaal naar Nigeria verscheept in gebruikte voertuigen
Duizenden tonnen e-waste worden illegaal naar Nigeria verscheept in gebruikte voertuigen Wijdverbreid risico op grondwaterverontreiniging door chroom
Wijdverbreid risico op grondwaterverontreiniging door chroom Verkiezingscycli beïnvloeden de vernietiging van Atlantische regenwouden in het zuiden en zuidoosten van Brazilië
Verkiezingscycli beïnvloeden de vernietiging van Atlantische regenwouden in het zuiden en zuidoosten van Brazilië
Hoofdlijnen
- waar ligt de oorsprong van een mens?
- Hoe een dodelijke salmonellasoort zijn infectietactieken verfijnt
- Waarom worden mitochondria en chloroplast semi -autonome organellen genoemd?
- Wat is een niet-Mendiliaanse eigenschap?
- Waarom orgaansysteem zuurstof naar cellen brengt?
- Studie is eerst om de unieke vocale structuur van lemuren te beschrijven en opnieuw te creëren
- Symbiotische bacteriën beschermen keverlarven tegen ziekteverwekkers
- Wat is het pad van een zuurstofmolecuul wanneer het het menselijk lichaam binnenkomt?
- Gestrande walvisachtigen? Daar is een app voor
- Directe transformatie van CH3Cl naar azijnzuur via een carbonyleringsreactie

- In Australië worden zelfsteriliserende micronaalden ontwikkeld voor veiligere vaccinaties
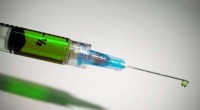
- Wetenschappers stellen nieuwe slimme luminescente materialen van Au(I)-dubbelzouten voor
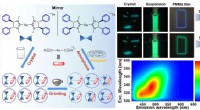
- Het gebruik van materiaal met een hoge energiedichtheid in het ontwerp van de elektrode verbetert lithiumzwavelbatterijen

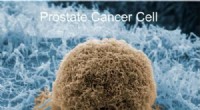
- Goedkope detector is als klittenband voor kankercellen
 Nieuwe studie werpt licht op het mysterieuze dimmen van Betelgeuze
Nieuwe studie werpt licht op het mysterieuze dimmen van Betelgeuze Huisartikelen worden slimmer en griezeliger, of je het nu leuk vindt of niet
Huisartikelen worden slimmer en griezeliger, of je het nu leuk vindt of niet Robots kunnen helemaal naar Mars gaan, maar ze kunnen de boodschappen niet ophalen
Robots kunnen helemaal naar Mars gaan, maar ze kunnen de boodschappen niet ophalen Is teamwetenschap productief? Studie meet het collaboratieve karakter van translationele geneeskunde
Is teamwetenschap productief? Studie meet het collaboratieve karakter van translationele geneeskunde  Volgorde aanbrengen in, mRNA, of misschien nanokristallen? Wijd open veld voor Nobelprijs voor Scheikunde
Volgorde aanbrengen in, mRNA, of misschien nanokristallen? Wijd open veld voor Nobelprijs voor Scheikunde Ecotoxiciteit:alles duidelijk voor zilveren nanodeeltjes?
Ecotoxiciteit:alles duidelijk voor zilveren nanodeeltjes?  Onderzoekers ontdekken dat 2-D overgangsmetaalcarbiden reageren met water, een deur openen naar hun onbekende chemie
Onderzoekers ontdekken dat 2-D overgangsmetaalcarbiden reageren met water, een deur openen naar hun onbekende chemie Wat gitaarvissen en vliegtuigvleugels gemeen hebben
Wat gitaarvissen en vliegtuigvleugels gemeen hebben
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

