
Wetenschap
Wat zijn de verklaringen voorgesteld door Neils Bohr?
Niels Bohr's belangrijkste verklaringen en bijdragen:
Niels Bohr was een cruciale figuur bij de ontwikkeling van de kwantummechanica, waardoor belangrijke bijdragen werden geleverd aan ons begrip van de atoomstructuur en de aard van het licht. Hier zijn enkele van zijn belangrijkste verklaringen en bijdragen:
1. Bohr -model van het atoom:
* elektronen rond de kern in gekwantiseerde energieniveaus. Dit betekent dat elektronen alleen specifieke, discrete energieniveaus kunnen bezetten, niet continu.
* elektronen kunnen tussen energieniveaus springen door fotonen te absorberen of uit te stoten. Dit verklaart de afzonderlijke spectrale lijnen waargenomen in atomaire emissie- en absorptiespectra.
* Het hoekmomentum van elektronen in een atoom wordt gekwantiseerd. Dit betekent dat alleen specifieke waarden van hoekmomentum zijn toegestaan, waardoor de toegestane energieniveaus verder worden gedefinieerd.
2. Complementariteitsprincipe:
* Dualiteit van golfdeeltjes: Licht en materie vertonen zowel golfachtige als deeltjesachtige eigenschappen, afhankelijk van de experimentele opstelling. Dit betekent dat het onmogelijk is om beide eigenschappen tegelijkertijd te observeren.
* onzekerheidsprincipe: Dit principe, voorgesteld door Werner Heisenberg, is nauw verwant aan het complementariteitsprincipe van Bohr. Het stelt dat het onmogelijk is om zowel de positie als het momentum van een deeltje met perfecte nauwkeurigheid te kennen. Dit beperkt fundamenteel ons vermogen om het toekomstige gedrag van kwantumsystemen te voorspellen.
3. Kopenhagen interpretatie van kwantummechanica:
* waarschijnlijkheidsinterpretatie: De golffunctie van een kwantumsysteem beschrijft de kans op het vinden van een deeltje in een bepaalde toestand. Dit houdt in dat de uitkomst van kwantumexperimenten inherent probabilistisch en niet deterministisch is.
* meetprobleem: De handeling van het meten van een kwantumsysteem zorgt ervoor dat het instort in een specifieke toestand, maar het precieze mechanisme van deze ineenstorting blijft een onderwerp van debat.
4. Bohr's atomaire theorie:
* Quantumsprongen: Elektronenovergang tussen energieniveaus door fotonen te absorberen of te emitteren, wat leidt tot karakteristieke spectrale lijnen.
* Elektronenconfiguratie: De specifieke opstelling van elektronen in verschillende energieniveaus verklaart de chemische eigenschappen van elementen.
5. Wetenschapsfilosofie:
* Belang van taal en interpretatie: De betekenis en interpretatie van wetenschappelijke theorieën zijn cruciaal voor het begrijpen van hun implicaties.
* Limieten van klassieke fysica: Klassieke fysica is onvoldoende voor het beschrijven van fenomenen op atomaire en subatomaire niveaus.
Dit zijn slechts enkele van de belangrijkste bijdragen van Niels Bohr. Zijn werk bracht een revolutie teweeg in ons begrip van het atoom en de aard van de realiteit, waardoor het toneel was voor de ontwikkeling van moderne kwantummechanica.
 Wat is de samengestelde naam van Mg3AS2?
Wat is de samengestelde naam van Mg3AS2?  Hoe het aantal atomen te berekenen gezien de massa's van gram en atoom
Hoe het aantal atomen te berekenen gezien de massa's van gram en atoom  Het in kaart brengen van de driedimensionale structuur van katalytische centra helpt bij het ontwerpen van nieuwe en verbeterde katalysatoren
Het in kaart brengen van de driedimensionale structuur van katalytische centra helpt bij het ontwerpen van nieuwe en verbeterde katalysatoren Kristallen die aardgas zuiveren
Kristallen die aardgas zuiveren Nieuwe strategie verbetert de zuurstofreductieprestaties van perovskieten in waterstofbrandstofcellen
Nieuwe strategie verbetert de zuurstofreductieprestaties van perovskieten in waterstofbrandstofcellen
 NASA-NOAA-satelliet toont omvang van Irmas-restanten
NASA-NOAA-satelliet toont omvang van Irmas-restanten Om enquêtes en ander onderzoek te verbeteren, bestuderen entomologen hoe kleuren wilde bijen aantrekken
Om enquêtes en ander onderzoek te verbeteren, bestuderen entomologen hoe kleuren wilde bijen aantrekken  Vechten of vluchten? Vocale signalen helpen herten beslissen tijdens de paartijd
Vechten of vluchten? Vocale signalen helpen herten beslissen tijdens de paartijd  Hoe een Green New Deal ontwikkelingslanden zou kunnen exploiteren
Hoe een Green New Deal ontwikkelingslanden zou kunnen exploiteren Archaea bevat aanwijzingen voor oude oceaantemperaturen
Archaea bevat aanwijzingen voor oude oceaantemperaturen
Hoofdlijnen
- Moeders geven de voorkeur aan dochters,
- Onderzoekers tonen aan dat de lengte van telomeren de levensverwachting in het wild voorspellen
- Wat is het sterke bewijs van gemeenschappelijke afkomst tussen organisme dat ze deelt?
- Cellen jeugdig houden:hoe telomere-opbouwende eiwitten in de plooi worden getrokken
- Wat is de levensduur van huidcellen?
- Foster-kikkervisjes triggeren het ouderlijk instinct bij gifkikkers
- Zoete geheimen van de laurierbes:genetische inzichten zullen de vruchtkwaliteit transformeren
- Hoe bacteriën zwemmen:onderzoekers ontdekken nieuwe mechanismen
- Welk type koolhydraat wordt gevonden in ontbijtgranen?
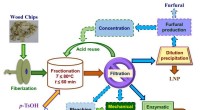
- Delignificatie van houtmonsters met p-tolueensulfonzuur als recyclebare hydrotroop
- Onderzoekers boeken vooruitgang in de controle over kameleonachtig materiaal voor computers van de volgende generatie

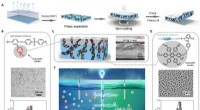
- Een efficiëntere op membraan gebaseerde generator voor het oogsten van osmotisch vermogen (update)
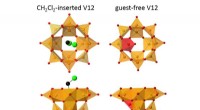
- Omgedraaide metaaloxide kooi kan kooldioxide scheiden van koolmonoxide
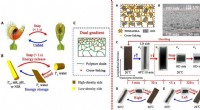
- Ontwikkeling van een ultrasnel biomimetisch snapping hydrogelmateriaal met twee gradiënten
 Kunnen computers net als mensen beslissingen nemen? Een nieuwe studie kan het antwoord hebben
Kunnen computers net als mensen beslissingen nemen? Een nieuwe studie kan het antwoord hebben  Er is meer nodig dan goede bedoelingen om de afvalbergen van Nairobis op te ruimen
Er is meer nodig dan goede bedoelingen om de afvalbergen van Nairobis op te ruimen Biomineralen maken:het recept van de natuur is oud, meer dan eens geëvolueerd
Biomineralen maken:het recept van de natuur is oud, meer dan eens geëvolueerd Accuplacer-regels
Accuplacer-regels  Facebook breidt factcheck-inspanningen uit naar foto's, videos
Facebook breidt factcheck-inspanningen uit naar foto's, videos Wat zijn arachnoïden?
Wat zijn arachnoïden?  Welke toestanden van materie bestaan er in het menselijk lichaam?
Welke toestanden van materie bestaan er in het menselijk lichaam?  Bestaat er een verband tussen muziek en geluk?
Bestaat er een verband tussen muziek en geluk?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

