
Wetenschap
Hoe verklaart de kinetische theorie het feit dat druk van een gas in afgesloten container constant voor onbepaalde tijd volume en temperatuur constant wordt gehouden?
Sleutelconcepten van kinetische theorie
* gasmoleculen zijn in constante willekeurige beweging. Ze botsen met elkaar en de wanden van de container.
* De gemiddelde kinetische energie van de moleculen is evenredig met de absolute temperatuur. Dit betekent dat heter gassen sneller bewegende moleculen hebben.
* botsingen met de containerwanden creëren druk. Hoe frequenter en krachtig de botsingen, hoe hoger de druk.
Verklaring
1. Constante temperatuur: Omdat de temperatuur constant is, blijft de gemiddelde kinetische energie van de gasmoleculen constant. Dit betekent dat de gemiddelde snelheid van de moleculen niet verandert.
2. constant volume: Het vaste volume van de container betekent dat er een beperkte ruimte is voor de gasmoleculen om rond te bewegen.
3. Balanced botsingen: Met constante temperatuur en volume gebeurt het volgende:
* Botsfrequentie: Het aantal botsingen tussen gasmoleculen en de containerwanden blijft constant. Er is een vaste snelheid van botsingen omdat de moleculen met een constante snelheid bewegen en beperkt zijn tot een vaste ruimte.
* Botsingskracht: Omdat de gemiddelde kinetische energie (en dus snelheid) van de moleculen constant is, blijft de kracht van elke botsing met de wanden ook constant.
4. Constante druk: De druk die door het gas wordt uitgeoefend, is direct gerelateerd aan de snelheid en kracht van botsingen met de containerwanden. Omdat zowel de frequentie als de kracht van deze botsingen constant blijven, blijft de druk constant.
Samenvattend
De constante temperatuur zorgt ervoor dat de gasmoleculen een constante gemiddelde snelheid behouden, terwijl het constante volume hen beperkt tot een vaste ruimte. Dit resulteert in een constante snelheid en kracht van botsingen met de containerwanden, wat leidt tot een stabiele en onveranderlijke druk.
 Hoeveel protonen, neutronen en elektronen zitten er in polonium?
Hoeveel protonen, neutronen en elektronen zitten er in polonium?  Hernieuwbare elektriciteit gebruiken voor industriële hydrogeneringsreacties
Hernieuwbare elektriciteit gebruiken voor industriële hydrogeneringsreacties Insuline sorteren en afscheiden op vervaldatum
Insuline sorteren en afscheiden op vervaldatum Wat voor soort atoom of molecuul is heliumlucht in een ballon gemaakt?
Wat voor soort atoom of molecuul is heliumlucht in een ballon gemaakt?  Nieuwe methode keert de zelfassemblage van vloeibare kristallen om
Nieuwe methode keert de zelfassemblage van vloeibare kristallen om
 Kosmische stofdeeltjes zetten bellenparachutes op hun vurige afdaling, wetenschappers ontdekken
Kosmische stofdeeltjes zetten bellenparachutes op hun vurige afdaling, wetenschappers ontdekken Wat is belangrijker in plantengroei lichtwater of temperatuur?
Wat is belangrijker in plantengroei lichtwater of temperatuur?  De toekomst zal waarschijnlijk minder geschikt zijn voor skiën, dankzij de klimaatverandering
De toekomst zal waarschijnlijk minder geschikt zijn voor skiën, dankzij de klimaatverandering  Mold & Cast Fossils
Mold & Cast Fossils Wat is het gebruik van knopschilfers in houtachtige planten?
Wat is het gebruik van knopschilfers in houtachtige planten?
Hoofdlijnen
- Hoe menselijke activiteiten een van 's werelds meest afgelegen walvissoorten beïnvloeden
- Waarom vertoont eencellig organisme geen specialisatie?
- Hoe menselijke hersenen zo groot werden
- Geen designerbaby’s, maar genbewerking om ziekten te voorkomen? Misschien
- Zijn celwandplanten of dieren?
- Al het wetenschappelijk denken begint met wat?
- Wat voor soort bacteriën zou waarschijnlijk een ziekte veroorzaken?
- Wetenschappelijke evaluatie van neushoorndiëten verbetert dierentuin
- Wat is BCG Matrix?
- De harige buik van honingbijen laat zien hoe je energie kunt besparen, slijtage aan materialen verminderen

- Superoxide produceert hydroxylradicalen die opgeloste organische stoffen in water afbreken
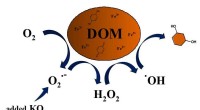
- Onderzoekers lossen een wetenschappelijk mysterie over verdamping op

- Forensische onderzoekers vinden een nauwkeurigere manier om de leeftijd van overledenen te schatten

- Wetenschappers overhalen eiwitten om synthetische structuren te vormen met een methode die de natuur nabootst

 Argentinië machtigt Starlink, rivaal Amazon Kuiper
Argentinië machtigt Starlink, rivaal Amazon Kuiper  Onderzoek meldt doorbraak om plantverbeteringen te meten om boeren te helpen de productie te verhogen
Onderzoek meldt doorbraak om plantverbeteringen te meten om boeren te helpen de productie te verhogen Poo-pyrus:milieuvriendelijk papier gemaakt van poep
Poo-pyrus:milieuvriendelijk papier gemaakt van poep  Als twee soorten een ander dieet eten, maar een van de voedselbronnen wordt geëlimineerd en beide tot hetzelfde voedsel worden gedwongen welke verandering in hybride zone komt waarschijnlijk voor?
Als twee soorten een ander dieet eten, maar een van de voedselbronnen wordt geëlimineerd en beide tot hetzelfde voedsel worden gedwongen welke verandering in hybride zone komt waarschijnlijk voor?  Energiezuinige supergeleidende kabel voor toekomstige technologieën
Energiezuinige supergeleidende kabel voor toekomstige technologieën Ontdekking kan game-changer zijn voor farmaceutische producten
Ontdekking kan game-changer zijn voor farmaceutische producten 10 Feiten over fossielen
10 Feiten over fossielen  Karakteriseringsstrategie helpt bij het scheiden van metaal met een hoge zuiverheid
Karakteriseringsstrategie helpt bij het scheiden van metaal met een hoge zuiverheid
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

