
Wetenschap
Wat is een juiste beschrijving van enthalpie -reactie?
Reaction van reactie:een correcte beschrijving
Enthalpy of Reaction verwijst naar de verandering in enthalpie Dat gebeurt tijdens een chemische reactie.
Hier is een uitsplitsing:
* Enthalpy (H) :Een thermodynamische eigenschap die het totale warmtegehalte van vertegenwoordigt van een systeem. Het omvat de interne energie van het systeem plus het product van druk en volume.
* Verandering in enthalpie (ΔH) :Het verschil in enthalpie tussen de producten en reactanten van een reactie.
* exotherme reacties (ΔH <0) :Reacties die warmte vrijgeven in de omgeving. De enthalpie van de producten is lager dan de enthalpie van de reactanten.
* Endothermische reacties (ΔH> 0) :Reacties die warmte absorberen uit de omgeving. De enthalpie van de producten is hoger dan de enthalpie van de reactanten.
Samenvattend vertelt de enthalpie van de reactie ons of een reactie warmte vrijgeeft of absorbeert, en door hoeveel.
Hier zijn enkele belangrijke punten om te onthouden:
* Enthalpy of Reaction is een statusfunctie , wat betekent dat het alleen afhangt van de initiële en uiteindelijke toestanden van het systeem, niet op het genomen pad.
* De reactietealpe kan worden berekend uit de enthalpen van formatie van de reactanten en producten.
* Enthalpy of Reaction is een nuttig hulpmiddel om te voorspellen of een reactie spontaan zal optreden of niet.
Voorbeeld:
De verbranding van methaan (CH4) is een exotherme reactie met een negatieve reactietealpie (-890 kJ/mol). Dit betekent dat 890 kJ warmte wordt vrijgegeven per mol verbrande methaan.
Vergelijking:
CH4 (G) + 2O2 (G) → CO2 (G) + 2H2O (L) AH =-890 KJ/MOL
Deze informatie helpt ons te begrijpen dat deze reactie warmte vrijgeeft, en daarom wordt deze gebruikt als brandstofbron.
 HEY Wat is de formule van deze composities:a) 4-(1,2-dimetilpropil)-2,3-dimetiloctanob) 4,6-dimetil-4-nonen-2-inoc) 4-metil-2-pentenald) 1 ,3-difenil-2-propenonae) ácido 3-hidroxi-4-oxopentanoicoUW ANTWOORD ZAL ME ECHT HELPEN:)?
HEY Wat is de formule van deze composities:a) 4-(1,2-dimetilpropil)-2,3-dimetiloctanob) 4,6-dimetil-4-nonen-2-inoc) 4-metil-2-pentenald) 1 ,3-difenil-2-propenonae) ácido 3-hidroxi-4-oxopentanoicoUW ANTWOORD ZAL ME ECHT HELPEN:)?  Kunstmatige intelligentie gebruiken om de rozen te ruiken
Kunstmatige intelligentie gebruiken om de rozen te ruiken Nieuw ontwikkelde screeningprocessen zullen het onderzoek naar koolstofafvang versnellen
Nieuw ontwikkelde screeningprocessen zullen het onderzoek naar koolstofafvang versnellen Wetenschappers verhogen de oplosbaarheid van een effectief antidepressivum met een factor 1.600
Wetenschappers verhogen de oplosbaarheid van een effectief antidepressivum met een factor 1.600  Wat vertegenwoordigt het periodegetal?
Wat vertegenwoordigt het periodegetal?
 Milieurisico's in de toendra
Milieurisico's in de toendra  Methoden voor het volgen van microbiële fecale vervuiling in water
Methoden voor het volgen van microbiële fecale vervuiling in water Nieuw gemodificeerd CRISPR-eiwit kan passen in virussen die worden gebruikt voor gentherapie
Nieuw gemodificeerd CRISPR-eiwit kan passen in virussen die worden gebruikt voor gentherapie  Zijn de inheemse duiven van Australië eenden?
Zijn de inheemse duiven van Australië eenden?  Hoe genetica, hulpbronnen en een verre verwant de killifish hielpen zich aan te passen aan extreme vervuiling
Hoe genetica, hulpbronnen en een verre verwant de killifish hielpen zich aan te passen aan extreme vervuiling
Hoofdlijnen
- Wat zijn de drie belangrijkste bewijsgebieden voor evolutie?
- Wat geeft plantencel hun stijfheid?
- Onderzoekers onthullen de dynamische structuur van FLVCR-eiwitten en hun functie bij het transport van voedingsstoffen
- Hoe vermeld je twee soorten levende wezens beschrijven kort hoe ze anders en vergelijkbaar zijn?
- Welke bloedcel beschermen het lichaam?
- Hoe evolutie de magnetische sensor bij vogels heeft geoptimaliseerd
- Waarom vissen naar beneden kijken als ze zwemmen
- Wat beschrijft het beste de manier waarop genen chromosomen en DNA gerelateerd zijn?
- Welke veeigenschappen zijn het meest erfelijk?
- De lange en de korte van DNA-replicatie

- Onderzoekers vinden nieuwe vorm voor hydrofobe moleculen in water

- Niet-invasieve beeldvorming van atomaire rangschikking op sub-angstromschaal in 2D hybride perovskieten
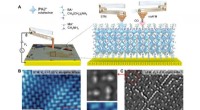
- Nieuwe methode benchmarkt organische gemengde geleiders
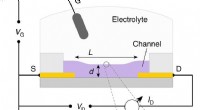
- Nieuw inzicht in de moleculaire wapens van het plantenmicrobioom
 New Yorks overdreven politieke benadering van openbaar vervoer
New Yorks overdreven politieke benadering van openbaar vervoer Welke twee fundamentele tendensen in de natuur lijken het reactieproces te beïnvloeden?
Welke twee fundamentele tendensen in de natuur lijken het reactieproces te beïnvloeden?  Video:Nieuwe radarmissie voor Europa
Video:Nieuwe radarmissie voor Europa  Hoeveel is 161 pond in kg?
Hoeveel is 161 pond in kg?  Warme fronten of koud reizen met dezelfde snelheid?
Warme fronten of koud reizen met dezelfde snelheid?  Magnetisme van zwarte gaten verrassend slap
Magnetisme van zwarte gaten verrassend slap Waarom hebben levende organismen mineralen nodig?
Waarom hebben levende organismen mineralen nodig?  Wat zijn mechanische bakmiddelen?
Wat zijn mechanische bakmiddelen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

