
Wetenschap
Hoe is de atomaire massa van elk element op het periodieke tabel berekenen?
1. Isotopen:
* Atomen van hetzelfde element kunnen verschillende aantallen neutronen hebben. Deze variaties worden isotopen genoemd. Carbon-12 en koolstof-14 zijn bijvoorbeeld beide isotopen van koolstof, met verschillende aantallen neutronen.
* Elke isotoop heeft een specifieke massa.
2. Overvloed:
* Isotopen komen in de natuur voor met verschillende overvloed. Carbon-12 is bijvoorbeeld veel overvloediger dan koolstof-14.
3. Gewogen gemiddeld:
* De atoommassa op het periodiek systeem is het gewogen gemiddelde van de massa van alle isotopen. Dit betekent dat de massa van elke isotoop wordt vermenigvuldigd met zijn natuurlijke overvloed en vervolgens worden alle producten bij elkaar opgeteld.
formule:
Atomische massa =(massa isotoop 1 * overvloed van isotoop 1) + (massa isotoop 2 * overvloed van isotoop 2) + ...
Voorbeeld:
Laten we eens kijken naar chloor (CL), dat twee grote isotopen heeft:
* chloor-35: Mass =34.9689 AMU, overvloed =75,77%
* chloor-37: Mass =36.9659 AMU, overvloed =24,23%
Berekening:
Atomische massa van CL =(34.9689 AMU * 0.7577) + (36.9659 AMU * 0.2423)
=26.4957 AMU + 8.9568 AMU
= 35.4525 Amu
Daarom is de atoommassa van chloor op het periodiek systeem ongeveer 35,45 AMU.
Opmerking:
* Atomische massa's worden meestal uitgedrukt in atomaire massa -eenheden (AMU).
* De atomaire massa's op het periodiek systeem zijn over het algemeen afgerond op twee of drie decimalen.
* Sommige elementen hebben geen stabiele isotopen en hebben daarom geen natuurlijke overvloed. Voor deze elementen is de atomaire massa gebaseerd op de langstlevende isotoop.
 Gebruik van het kookpunt Elevation
Gebruik van het kookpunt Elevation Mini-centrifuge voor eenvoudigere studie van bloedcellen opent nieuwe organ-on-chip mogelijkheden
Mini-centrifuge voor eenvoudigere studie van bloedcellen opent nieuwe organ-on-chip mogelijkheden Hoe ionische bindingen gemaakt?
Hoe ionische bindingen gemaakt?  Is een asymmetrisch koolstofatoom gebonden aan vier verschillende atomen of groepen?
Is een asymmetrisch koolstofatoom gebonden aan vier verschillende atomen of groepen?  Helium is essentieel voor onderzoek en medische apparatuur, maar het is niet hernieuwbaar en moeilijk te recyclen
Helium is essentieel voor onderzoek en medische apparatuur, maar het is niet hernieuwbaar en moeilijk te recyclen
 Plotselinge overstromingen doden 37 in Indiase toeristische hotspot Kerala
Plotselinge overstromingen doden 37 in Indiase toeristische hotspot Kerala Technologie- en beleidspaden naar de emissiedoelen van Parijs
Technologie- en beleidspaden naar de emissiedoelen van Parijs Visueel zoeken om te winkelen:gimmick of spelverandering?
Visueel zoeken om te winkelen:gimmick of spelverandering?  Boeren gebruiken technologie om elke druppel uit de Colorado-rivier te persen
Boeren gebruiken technologie om elke druppel uit de Colorado-rivier te persen Satelliet toont wat afschuiving in orkaan Hilary
Satelliet toont wat afschuiving in orkaan Hilary
Hoofdlijnen
- Dit organisme is hoogstwaarschijnlijk lid van het heksenkoninkrijk?
- Hoe kunnen foresice-wetenschappers DNA gebruiken bij een misdaad?
- Een pinguïn met een onconventionele roep inspireert onderzoekers om de manier waarop ze pinguïns bestuderen te veranderen
- Gedachtenexperiment:wat is ons transhumane pad voorbij de aarde?
- Wetenschappers ontdekken fossielen van gigantische zeehagedis die 66 miljoen jaar geleden over de oceanen heerste
- Wetenschappers ontdekken de basisprincipes van hoe drukgevoelige piëzo-eiwitten werken
- Wat is de rol van de milt en het beenmerg in de bloedsomloop?
- Welk vakgebied wordt geassocieerd met het bestuderen van planten?
- Wat is de functie van chromatine en chromosomen?
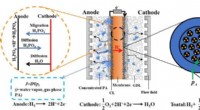
- Het voorspellen van de distributie van fosforzuur en water in een hoge-temperatuur polymeer elektrolytmembraan brandstofcel
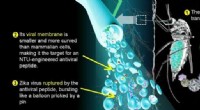
- Peptide maakt misbruik van achilleshiel van Zika-virus
- Wetenschappers ontwikkelen onzichtbare anti-namaaketiketten

- Superrekbaar, supercompressibele supercondensatoren
- Firefly-gen verlicht het vermogen van geoptimaliseerd CRISPR-Cpf1 om het menselijk genoom efficiënt te bewerken

 Kwantumwrijving - voorbij de lokale evenwichtsbenadering
Kwantumwrijving - voorbij de lokale evenwichtsbenadering Onderzoek toont aan dat flexibele werkgrenzen vaak veranderen in werk zonder grenzen
Onderzoek toont aan dat flexibele werkgrenzen vaak veranderen in werk zonder grenzen Explainer:hoe Richard Branson zijn eigen raket naar de ruimte zal rijden
Explainer:hoe Richard Branson zijn eigen raket naar de ruimte zal rijden Een wiskundige vergelijking die het gedrag van nanofoams verklaart
Een wiskundige vergelijking die het gedrag van nanofoams verklaart Plasticvervuiling:Chemische recycling kan een oplossing bieden
Plasticvervuiling:Chemische recycling kan een oplossing bieden Wat begrijpt u bij termijnonderzoek?
Wat begrijpt u bij termijnonderzoek?  Hoe snel zijn 7 knopen?
Hoe snel zijn 7 knopen?  Wat is een manier waarop mensen natuurlijke hulpbronnen kunnen behouden?
Wat is een manier waarop mensen natuurlijke hulpbronnen kunnen behouden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

