
Wetenschap
Wat gebeurt er als de kaliumpermanganaatoplossing daalt naar water?
1. Oplossing:
* Kmno4 lost op in water, die kaliumionen (k+) en permanganaationen vormt (mno4-).
* De oplossing verandert een karakteristieke diepe paarse kleur vanwege de aanwezigheid van permanganaationen.
2. Oxidatie:
* Permanganaationen zijn sterke oxidatiemiddelen.
* Ze kunnen reageren met verschillende stoffen in het water en ze oxideren.
* De mate van oxidatie hangt af van de concentratie van de permanganaatoplossing, de pH van het water en de aard van de aanwezige stoffen.
3. Kleurverandering:
* Als permanganaationen oxideren stoffen, worden ze gereduceerd tot mangaandioxide (MNO2), wat een bruine vaste stof is.
* Dit zorgt ervoor dat de paarse oplossing kleurloos of bruin wordt, afhankelijk van de hoeveelheid reductie.
4. PH Wijziging:
* De oplossing van KMNO4 verhoogt de pH van het water enigszins als gevolg van de vorming van hydroxide-ionen (OH-) tijdens het oxidatieproces.
Specifieke reacties:
* met organische verbindingen: KMNO4 kan organische verbindingen zoals alcoholen, alkenen en aldehyden oxideren en verschillende producten vormen.
* met ijzer (ii) ionen: KMNO4 oxideert ijzer (II) ionen (Fe2+) tot ijzer (III) ionen (Fe3+).
* met waterstofperoxide: KMNO4 reageert met waterstofperoxide (H2O2) om zuurstofgas te produceren.
Veiligheidsoverwegingen:
* Kaliumpermanganaat is een sterk oxidatiemiddel en kan gevaarlijk zijn als het onjuist wordt behandeld.
* Het kan huid- en oogirritatie veroorzaken en inname kan schadelijk zijn.
* Het is belangrijk om passende beschermende uitrusting te dragen, zoals handschoenen en bril, bij het hanteren van KMNO4.
Samenvattend: Het laten vallen van een kaliumpermanganaatoplossing in water resulteert in de oplossing, oxidatie van stoffen in het water en kleurverandering. De specifieke reacties en de mate van de veranderingen zijn afhankelijk van de concentratie van de oplossing, de pH van het water en de aard van de aanwezige stoffen.
 Wat zijn voorbeelden van elementen met één als hun valentie, dat wil zeggen monovalente elementen geven?
Wat zijn voorbeelden van elementen met één als hun valentie, dat wil zeggen monovalente elementen geven?  Onderzoekers kwantificeren, karakteriseren en identificeren functies van collageen, zijn subtypes
Onderzoekers kwantificeren, karakteriseren en identificeren functies van collageen, zijn subtypes Wat betekenen de grote in 2CO2?
Wat betekenen de grote in 2CO2?  Biofysici lossen de ware structuur van het veelbelovende optogenetische eiwit KR2 rhodopsine op
Biofysici lossen de ware structuur van het veelbelovende optogenetische eiwit KR2 rhodopsine op Waarom mag het water niet in de kolf druppelen?
Waarom mag het water niet in de kolf druppelen?
 Smeltend zee-ijs versnelt de natuurklok in het noordpoolgebied
Smeltend zee-ijs versnelt de natuurklok in het noordpoolgebied Bepalen wanneer mensen de planeet op grote schaal begonnen te beïnvloeden
Bepalen wanneer mensen de planeet op grote schaal begonnen te beïnvloeden Welke menselijke activiteiten zorgen voor meer koolstofdioxide in de atmosfeer?
Welke menselijke activiteiten zorgen voor meer koolstofdioxide in de atmosfeer?  Wereldwijde degradatie van land en natuur bedreigt welvaart en welzijn
Wereldwijde degradatie van land en natuur bedreigt welvaart en welzijn De waarde van mislukking in natuurbehoudsprogramma's
De waarde van mislukking in natuurbehoudsprogramma's
Hoofdlijnen
- Sla, kool voor zeekoeien? Feds en natuurbeschermers overwegen om zeekoeien te voeren na 1.000 doden
- Hoe denken wetenschappers dat protobionts zijn gevormd?
- Ecosysteem: definitie, types, structuur en voorbeelden
- Wat is de biologische levenscyclus van vleermuizen?
- Cytoplasma: definitie, structuur en functie (met diagram)
- Prolifereren of niet prolifereren? Een cellulaire lente antwoordt
- Wat is een systeem dat bestaat uit de darmen en longen van de nieren leverhuid en longen zuivert het lichaam door afvalmateriaal te elimineren?
- Neurale opnames van wilde vleermuizen onthullen een unieke organisatie van het middenhersenengebied voor het volgen en vangen van prooien
- Vang me als je kunt:hoe mRNA-therapieën in cellen worden afgeleverd
- Chemici warmen zich op voor preprint-servers

- Onderzoekers ter wereld onthullen de structuur van een belangrijk medicijndoelwit

- Ontdekking van hoe amyloïden metaalionen binden werpt licht op de eiwitfunctie
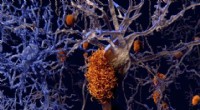
- Moleculaire chirurgie hervormt levend weefsel met elektriciteit maar zonder incisies

- Biomimetische strategie leidt tot sterke, recyclebaar rubber
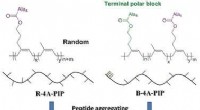
 Hoe vrienden kunnen samenwerken om zich te beschermen tegen ongewenste seksuele ervaringen in het eerste jaar van de universiteit
Hoe vrienden kunnen samenwerken om zich te beschermen tegen ongewenste seksuele ervaringen in het eerste jaar van de universiteit  Als Rusland vertrekt, wat is de volgende stap voor het internationale ruimtestation?
Als Rusland vertrekt, wat is de volgende stap voor het internationale ruimtestation? Gletsjerstad in gevaar bij volgende grote aardbeving in Nieuw-Zeeland
Gletsjerstad in gevaar bij volgende grote aardbeving in Nieuw-Zeeland Een dynamo maken
Een dynamo maken  Wat bevat één mol calciumchloride CaCl?
Wat bevat één mol calciumchloride CaCl?  Dodelijke zuigerpomp:hoe een kolonisatiefactor wordt uitgescheiden door bacteriële pili type 4
Dodelijke zuigerpomp:hoe een kolonisatiefactor wordt uitgescheiden door bacteriële pili type 4  Geheimen achter Game of Thrones onthuld door datawetenschap en netwerktheorie
Geheimen achter Game of Thrones onthuld door datawetenschap en netwerktheorie Hoe meet je de versnelling van een bewegend object dat schuin staat?
Hoe meet je de versnelling van een bewegend object dat schuin staat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

