
Wetenschap
Hoeveel mol water produceren produceren wanneer 45,3 waterstof reageert met zuurstof?
1. Schrijf de gebalanceerde chemische vergelijking:
2 H₂ + O₂ → 2 H₂o
Deze vergelijking vertelt ons dat 2 mol waterstof (H₂) reageert met 1 mol zuurstof (O₂) om 2 mol water (H₂o) te produceren.
2. Bepaal de beperkende reactant:
We moeten weten hoeveel zuurstof aanwezig is om de beperkende reactant te bepalen. De beperkende reactant is de stof die eerst wordt opgebruikt en de hoeveelheid gevormde product beperkt. Omdat de hoeveelheid zuurstof niet wordt gegeven, kunnen we de beperkende reactant niet bepalen.
3. Bereken de geproduceerde mol water (uitgaande van overtollige zuurstof):
* Ga uit van overtollige zuurstof: Als er een teveel aan zuurstof is, bepert de hoeveelheid waterstof de hoeveelheid geproduceerde water.
* Converteer grams van waterstof in mol: Je moet de molaire massa van waterstof (H₂) opzoeken die ongeveer 2 g/mol is.
* mol h₂ =(45,3 g h₂) / (2 g / mol h₂) =22,65 mol h₂
* Gebruik de molverhouding van de gebalanceerde vergelijking:
* De vergelijking toont 2 mol H₂ die 2 mol H₂o produceert. Dit betekent dat de molverhouding 1:1 is.
* Bereken mol water:
* mol H₂o =22,65 mol H₂ * (2 mol H₂o / 2 mol H₂) =22,65 mol H₂o
Conclusie:
Als er een overmaat zuurstof is, zal 45,3 gram waterstof 22,65 mol produceren van water.
Belangrijke opmerking: Als u een specifieke hoeveelheid zuurstof heeft, moet u die informatie gebruiken om de beperkende reactant te berekenen en de werkelijke hoeveelheid geproduceerde water te bepalen.
 Seismische gegevens verklaren continentale botsing onder Tibet
Seismische gegevens verklaren continentale botsing onder Tibet Wat is de naam voor een groot gebied met consistent organisme en weer?
Wat is de naam voor een groot gebied met consistent organisme en weer?  Terwijl Parijs dweilt, waarschuwing voor meer overstromingen in de toekomst van Europa
Terwijl Parijs dweilt, waarschuwing voor meer overstromingen in de toekomst van Europa Plotselinge ineenstorting van de oude biodiversiteit:was de opwarming van de aarde de boosdoener?
Plotselinge ineenstorting van de oude biodiversiteit:was de opwarming van de aarde de boosdoener?  Waarom Venetië eigenlijk een schoolvoorbeeld is voor overstromingspreventie
Waarom Venetië eigenlijk een schoolvoorbeeld is voor overstromingspreventie
Hoofdlijnen
- Onderzoekers vinden pesticiden in een derde van de geteste Australische kikkers. Hebben deze massale sterfgevallen veroorzaakt?
- Welk vakgebied wordt geassocieerd met het bestuderen van planten?
- Biodiversiteit bij krabben:meer dan alleen soorten tellen
- Wat zijn antioxidanten?
- Ontdekking van een nieuwe oude reuzenslang in India
- Hoe paren pissebedden als er roofdieren op de loer liggen? Impact van roofdieren op het koppelen van man en vrouw
- Regenwormen kunnen zich voortplanten in Mars-bodemsimulant
- Hoe jonge kippen spelen, kan aangeven hoe ze zich voelen
- Wat doen de ribosomen voor cellen?
- Onderzoekers ter wereld onthullen de structuur van een belangrijk medicijndoelwit

- Nieuwe studie onthult computergestuurde benadering voor het onderdrukken van kankertumorgroei
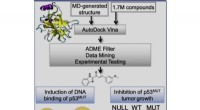
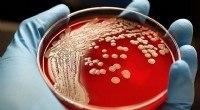
- Wetenschappers ontwikkelen nieuwe verbinding die beide soorten antibioticaresistente superbacteriën doodt
- Ter zake:nieuwe kwantumsensor biedt nieuwe benadering voor vroege diagnose via beeldvorming
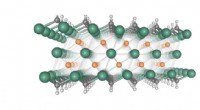
- 2D-materialen tot het uiterste brengen
 Hoe een vlinder uit Cocoon te helpen
Hoe een vlinder uit Cocoon te helpen Waarom complottheoretici geobsedeerd zijn door CERN
Waarom complottheoretici geobsedeerd zijn door CERN  Vier door onderzoek ondersteunde manieren om momenten van verbinding met dierbaren en vreemden te vinden
Vier door onderzoek ondersteunde manieren om momenten van verbinding met dierbaren en vreemden te vinden Kan het bestuderen van de menselijke oorsprong tieners helpen hun complexe emoties te begrijpen?
Kan het bestuderen van de menselijke oorsprong tieners helpen hun complexe emoties te begrijpen? Microfluïdisch systeem met celscheidende krachten kan ontrafelen hoe nieuwe pathogenen aanvallen
Microfluïdisch systeem met celscheidende krachten kan ontrafelen hoe nieuwe pathogenen aanvallen Gaat u van Latitude van noord naar zuid of oostwesten?
Gaat u van Latitude van noord naar zuid of oostwesten?  Expert op het gebied van cyberbeveiliging bespreekt inspanningen van het buitenland om het begrip van het publiek over COVID-19 te beïnvloeden
Expert op het gebied van cyberbeveiliging bespreekt inspanningen van het buitenland om het begrip van het publiek over COVID-19 te beïnvloeden Is CuS een ionische of moleculaire verbinding?
Is CuS een ionische of moleculaire verbinding?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

