
Wetenschap
Wanneer waterstof en zuurstof zich conformeren aan water, wat zou als beschouwd worden beschouwd?
De chemische reactie
* reactanten: Waterstof (H₂) en zuurstof (O₂) zijn de uitgangsmaterialen.
* Product: Water (H₂o) is de gevormde stof.
* Chemische vergelijking: 2h₂ + o₂ → 2h₂o
Wat te overwegen
1. binding: De waterstof- en zuurstofatomen vormen chemische bindingen, met name covalente bindingen, om watermoleculen te creëren. Dit omvat het delen van elektronen tussen de atomen.
2. Energieverandering: De vorming van water uit waterstof en zuurstof brengt een aanzienlijke hoeveelheid energie vrij, waardoor het een exotherme reactie is. Dit is de reden waarom het verbranden van waterstof in lucht (die zuurstof bevat) een vlam produceert.
3. Behoud van massa: De totale massa van de reactanten (waterstof en zuurstof) is gelijk aan de totale massa van het product (water). Dit volgt op de wet van behoud van massa.
4. Staten van materie: De reactie kan optreden in verschillende toestanden van materie:
* gas: Waterstof- en zuurstofgassen combineren om waterdamp te vormen.
* vloeistof: De waterdamp kan in vloeibaar water condenseren.
* solide: Bij voldoende temperaturen kan water in ijs bevriezen.
5. Omkeerbaarheid: De reactie kan worden omgekeerd onder bepaalde omstandigheden (elektrolyse), waarbij water kan worden afgebroken in waterstof en zuurstof.
Samenvattend, wanneer waterstof en zuurstof combineren om water te vormen, moet u rekening houden met de chemische binding, energieveranderingen, het behoud van massa, staten van materie en omkeerbaarheid van de reactie.
 Dieseltreinen kunnen passagiers blootstellen aan uitlaatgassen
Dieseltreinen kunnen passagiers blootstellen aan uitlaatgassen Soorten vliegende insecten in Florida
Soorten vliegende insecten in Florida  Deze stad is niet leefbaar:inwoners van New Delhi worden geconfronteerd met vieze lucht
Deze stad is niet leefbaar:inwoners van New Delhi worden geconfronteerd met vieze lucht 1.5C cap op opwarming bespaart wereldeconomie biljoenen:studie
1.5C cap op opwarming bespaart wereldeconomie biljoenen:studie Sluiting van kolencentrales in de VS redt levens en verbetert de oogstopbrengst
Sluiting van kolencentrales in de VS redt levens en verbetert de oogstopbrengst
Hoofdlijnen
- Vogelgriep doodt 700 zwarte gieren, sluit dierenasiel
- Wat is het voordeel van zaadkieming voor de mens?
- Studie ontwikkelt nieuwe manier om kankercellen te identificeren
- Bevruchting produceert een enkele cel genaamd?
- Glycolyse aan kinderen leren
- Hoe zijn de Europese zoetwatervissoorten in de loop van de tijd veranderd?
- Een laboratoriumtechnicus observeert een eencellulair organisme met twee lange flagella en kernen in het bloeduitstrijkje van persoon. Tot welk phylum hoort deze protozoa thuis?
- Wetenschappers onderzoeken de gevolgen voor de nationale veiligheid van genbewerking
- Wat zijn de drie criteria waarnaar Thomas Hunt Morgan zocht in genetische studies naar modelorganismen?
- Onderzoekers ontwikkelen dubbellaagse verf die warmte reflecteert

- Laserbehandeling toont potentieel voor vermindering van industriële chemische verwerking van voertuigen

- Manipuleren van ketenlopen in olefinen met behulp van aarde-overvloedige op ijzer gebaseerde katalysatoren
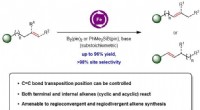
- Detectie van kanker door uitgeademde adem

- Groen alternatief voor PET kan nog groener

 Wat voor soort informatie wordt gepresenteerd door een wetenschapper die reden heeft om een bepaalde manier te presenteren?
Wat voor soort informatie wordt gepresenteerd door een wetenschapper die reden heeft om een bepaalde manier te presenteren?  Betere beslissingen nemen over sociale huisvesting
Betere beslissingen nemen over sociale huisvesting Een andere school heeft mobiele telefoons verboden, maar uit onderzoek blijkt dat een verbod het pesten niet stopt en de cijfers van leerlingen verbetert
Een andere school heeft mobiele telefoons verboden, maar uit onderzoek blijkt dat een verbod het pesten niet stopt en de cijfers van leerlingen verbetert Wat is fenpptype?
Wat is fenpptype?  De Clarke-exobelt, een methode om te zoeken naar mogelijke buitenaardse beschavingen
De Clarke-exobelt, een methode om te zoeken naar mogelijke buitenaardse beschavingen Twee doelen van mitose
Twee doelen van mitose  Wat zou de totale massa natriumhydroxide zijn?
Wat zou de totale massa natriumhydroxide zijn?  Welk huishoudelijk object is neutraal drijvend?
Welk huishoudelijk object is neutraal drijvend?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

