
Wetenschap
Waarom is koolstof en geen ander element de basis van alle organische moleculen?
1. Veelzijdigheid in binding:
* tetravalentie: Koolstof heeft vier valentie -elektronen, waardoor het vier covalente bindingen met andere atomen kan vormen. Dit zorgt voor de vorming van diverse en complexe moleculen.
* bindingssterkte: Koolstof-koolstofbindingen zijn sterk en stabiel en dragen bij aan de structurele integriteit van organische moleculen.
* Bondflexibiliteit: Koolstof kan enkele, dubbele en drievoudige bindingen vormen, wat leidt tot variaties in bindingshoeken en vormen van moleculen.
2. Mogelijkheid om ketens en ringen te vormen:
* kettingvorming: Koolstofatomen kunnen aan elkaar koppelen om lange ketens te vormen, waardoor de ruggengraat wordt geboden voor complexe moleculen zoals koolhydraten, eiwitten en lipiden.
* Ringvorming: Koolstof kan ook stabiele ringstructuren vormen, die essentieel zijn voor moleculen zoals suikers en nucleïnezuren.
3. Overvloed en beschikbaarheid:
* overvloedig: Koolstof is het vierde meest voorkomende element in het universum, waardoor het direct beschikbaar is.
* biologisch toegankelijk: Koolstof wordt gemakkelijk door de biosfeer gefietst en zorgt voor een continue toevoer voor levensprocessen.
4. Andere overwegingen:
* elektronegativiteit: Met de elektronegativiteit van koolstof kan het bindingen vormen met een breed scala aan elementen, waaronder waterstof, zuurstof, stikstof en fosfor, die essentieel zijn voor biologische functies.
* klein formaat: De kleine atoomgrootte van koolstof vergemakkelijkt de vorming van stabiele bindingen met andere atomen.
Waarom geen andere elementen?
Terwijl andere elementen zoals silicium ook lange ketens kunnen vormen, missen ze de veelzijdigheid en bindingssterkte van koolstof. Silica's grotere omvang en zwakkere bindingen maken het minder geschikt voor de complexe structuren en functies die nodig zijn voor het leven zoals we die kennen.
Samenvattend, de unieke combinatie van eigenschappen van Carbon, inclusief het vermogen om verschillende bindingen, ketens en ringen, de overvloed ervan en de reactiviteit met andere essentiële elementen te vormen, maakt het de ideale basis voor organische moleculen en de bouwstenen van het leven.
 Welk oplosmiddel kan balpeninkt van een stof verwijderen?
Welk oplosmiddel kan balpeninkt van een stof verwijderen?  Nieuw materiaal kan ademhalingsdruppels uit de lucht verwijderen
Nieuw materiaal kan ademhalingsdruppels uit de lucht verwijderen Kleurrijke oplossing voor een knelpunt in de chemische industrie
Kleurrijke oplossing voor een knelpunt in de chemische industrie Hoeveel equivalente Lewis-structuren zijn nodig om de binding in BrO4 te beschrijven?
Hoeveel equivalente Lewis-structuren zijn nodig om de binding in BrO4 te beschrijven?  Evenwichtige vergelijking voor de reactie van fenol en natriumcarbonaat?
Evenwichtige vergelijking voor de reactie van fenol en natriumcarbonaat?
 Milieuvriendelijke verzending helpt de vrachtkosten te verlagen
Milieuvriendelijke verzending helpt de vrachtkosten te verlagen Gevriesdroogde grond is meer geschikt voor het bestuderen van reactieve stikstofgasemissies in de bodem
Gevriesdroogde grond is meer geschikt voor het bestuderen van reactieve stikstofgasemissies in de bodem Hoe snel helpen bloemenstroken in steden de lokale bijen?
Hoe snel helpen bloemenstroken in steden de lokale bijen?  Afnemende aandacht voor klimaatverandering te midden van pandemie kan blijvende gevolgen hebben
Afnemende aandacht voor klimaatverandering te midden van pandemie kan blijvende gevolgen hebben Hoe kunnen we natuurvriendelijke wegen en spoorwegen aanleggen?
Hoe kunnen we natuurvriendelijke wegen en spoorwegen aanleggen?
Hoofdlijnen
- Welke moleculen kunnen zonder hulp door het plasmamembraan gaan?
- Wat drijft de evolutie van vogelneststructuren?
- Nieuwe soort veermijten ontdekt op de bedreigde spoorlijn van Okinawa
- Onderzoek toont aan hoe parasieten planten manipuleren om insecten aan te trekken
- Hoe informatie buiten de genetische sequentie wordt gecodeerd in plantensperma
- Waarom DNA de meest gunstige moleculen is voor genetisch materiaal en hoe RNA zich verhoudt tot deze Respect
- Moet de politie genetische informatie mogen gebruiken in openbare databases om criminelen op te sporen?
- Waarom zijn er zoveel hondenrassen, maar slechts een paar kattenrassen?
- Wat is een aanpassing voor Dahlia?
- Gezamenlijk onderzoek brengt koers naar honderden nieuwe nitriden

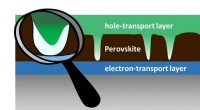
- Perovskiet-zonnecellen:perfectie niet vereist
- Meelwormen koken tot een smakelijke, gezonde, vleesachtige smaakmaker

- Zonne-energie omzetten in waterstofbrandstof, met hulp van fotosynthese

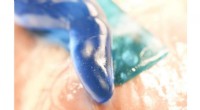
- Kleverig als het nat is:sterke kleefstof voor wondgenezing
 Wat is de naam van cement in het onderste huis vlakbij de grond?
Wat is de naam van cement in het onderste huis vlakbij de grond?  Herbruikbare sjablonen voor de productie van nanodraden
Herbruikbare sjablonen voor de productie van nanodraden Misdaad in de wijnstokken:Elzas bestrijdt druivendiefstal te paard
Misdaad in de wijnstokken:Elzas bestrijdt druivendiefstal te paard Wat zijn de voordelen van vegetatieve reproductie ten opzichte van seksuele reproductie?
Wat zijn de voordelen van vegetatieve reproductie ten opzichte van seksuele reproductie?  Astronaut krijgt speciale ijsbezorging voor 50e verjaardag
Astronaut krijgt speciale ijsbezorging voor 50e verjaardag Hoe verschillen ionische en covalente bindingen van waterstofbruggen?
Hoe verschillen ionische en covalente bindingen van waterstofbruggen?  Gehoornde dinosaurus Crittendenceratops ontdekt in Arizona
Gehoornde dinosaurus Crittendenceratops ontdekt in Arizona Nucleaire zorgen duwen Doomsday Clock dichter bij middernacht (update)
Nucleaire zorgen duwen Doomsday Clock dichter bij middernacht (update)
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

