
Wetenschap
Welk type binding voor de borane?
* Boor's elektroneficiëntie: Boron heeft slechts drie valentie -elektronen en het heeft er vier nodig om zijn octet te voltooien.
* het enige elektron van de waterstof: Elk waterstofatoom heeft één elektron om bij te dragen aan de binding.
* Elektronen delen: Boron deelt zijn drie elektronen met drie waterstofatomen en vormt drie B-H-bindingen. Er zijn echter niet genoeg elektronen om conventionele twee-elektronencovalente bindingen te vormen.
* drie-center twee-elektronenbindingen: Om dit te overwinnen, vormt het booratoom een speciaal type binding dat een drie-elektronenbinding met drie centrum wordt genoemd. In dit type binding worden de twee elektronen gedeeld tussen drie atomen.
Vereenvoudigde uitleg:
Stel je het booratoom voor in het midden van een driehoek, met een waterstofatoom in elke hoek. De twee elektronen worden gelijkelijk gedeeld tussen de drie atomen, waardoor een "bananenvormige" wolk van elektronendichtheid ontstaat.
Belangrijke opmerking: Borane (BH₃) is zeer reactief en bestaat voornamelijk als een dimeer, diboraan (b₂h₆). Diborane beschikt ook over drie-center twee-elektronenbindingen, maar de structuur is complexer.
 Hoe zou u metalen eigendom testen?
Hoe zou u metalen eigendom testen?  Exotische koolstofmicrokristallen in meteorietstof
Exotische koolstofmicrokristallen in meteorietstof Hoeveel SCF in een MCF van aardgas?
Hoeveel SCF in een MCF van aardgas?  Wetenschappers identificeren O-GlcNAcylatie als oorzaak van pancreastumorgroei door MDH1 te reguleren
Wetenschappers identificeren O-GlcNAcylatie als oorzaak van pancreastumorgroei door MDH1 te reguleren N de reactie tussen broom en natrium krijgt een atoom een elektron en vormt bromide-ion Br ndash. Wat gebeurt er met broom?
N de reactie tussen broom en natrium krijgt een atoom een elektron en vormt bromide-ion Br ndash. Wat gebeurt er met broom?
Hoofdlijnen
- Wat is de hoeveelheid kennis die is verkregen met behulp van methoden op basis van systematische observatie genaamd A?
- Wetenschappers beperken, bestuderen Chinook in het herstelde leefgebied van de Snoqualmie-rivier
- Waarom Hydrolyse lactose niet hydrolyseert?
- 245 miljoen jaar oude fossielen bieden nieuwe inzichten in de evolutie en voedingsstrategieën van waterinsecten
- The Stages of the Human Decomposition Process
- Percepties over wat er nodig is om te slagen in STEM-gebieden kunnen vrouwen buitensluiten
- Wat de afnemende kariboe-populaties en het totale jachtverbod betekenen voor de Inuit-gemeenschappen in Labrador
- Pythons zijn echte chokekunstenaars:grootte alleen verklaart niet hoe ze zulke grote prooien kunnen eten
- Gebruiken paddenstoelen echt taal om met elkaar te praten? Een schimmelexpert gaat op onderzoek uit
- Kunnen tweelinggrenzen bestand zijn tegen vermoeiingsscheuren?
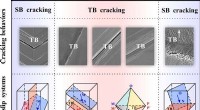
- Oppervlakken die als gekkovoeten vastgrijpen, kunnen gemakkelijk in massa worden geproduceerd

- Wetenschappers ontdekken nieuwe klasse van halfgeleidende entropie-gestabiliseerde materialen

- Een nieuwe manier om zachte materialen te combineren

- Vooruitgang in de goedkope elektrochemische synthese van ammoniak
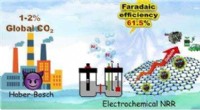
 Waarom zaagsel ontvlambaar?
Waarom zaagsel ontvlambaar?  Vluchten geannuleerd omdat tyfoon Tapah Japan nadert
Vluchten geannuleerd omdat tyfoon Tapah Japan nadert Heeft de zwaartekrachtgolfdetector donkere materie gevonden?
Heeft de zwaartekrachtgolfdetector donkere materie gevonden?  3D-printen op nanoschaal gebruiken om lichtveldafdrukken met hoge resolutie te maken
3D-printen op nanoschaal gebruiken om lichtveldafdrukken met hoge resolutie te maken Turbulentie en beschikbaarheid van nutriënten zorgen voor veranderingen in microben in de Rode Zee
Turbulentie en beschikbaarheid van nutriënten zorgen voor veranderingen in microben in de Rode Zee Big data belooft beter grondwaterbeheer in Californië
Big data belooft beter grondwaterbeheer in Californië De maan die rond de Dinky-asteroïde draait, bestaat eigenlijk uit twee kleine manen die aan elkaar zijn geplakt
De maan die rond de Dinky-asteroïde draait, bestaat eigenlijk uit twee kleine manen die aan elkaar zijn geplakt  Hoe vaak is Mount Santorini uitgebroken?
Hoe vaak is Mount Santorini uitgebroken?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

