
Wetenschap
Wetenschappers identificeren O-GlcNAcylatie als oorzaak van pancreastumorgroei door MDH1 te reguleren
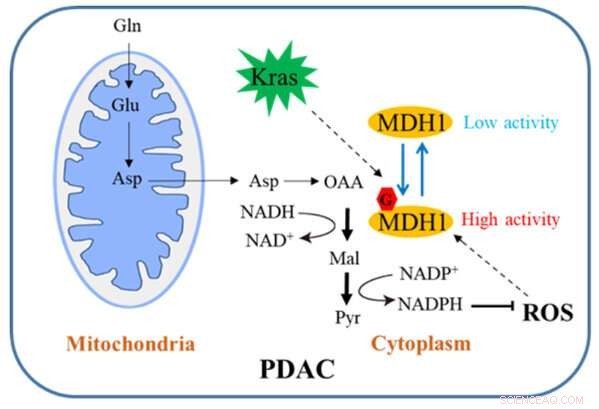
Schematisch diagram van hoe MDH1-glycosylering de PDAC-groei reguleert. Krediet:Universiteit van Zhejiang
Pancreaskanker is een buitengewoon kwaadaardige tumor in het spijsverteringsstelsel en de vijfjaarsoverleving is iets meer dan 10%. Metabolische veranderingen zijn een van de kenmerken van tumorcellen. Oncogene Kras-geactiveerde pancreas ductaal adenocarcinoom (PDAC) cellen zijn sterk afhankelijk van een onconventionele glutamine (Gln) katabole route om celgroei te ondersteunen.
In de conventionele route wordt Gln eerst omgezet in aspartaat (Asp), dat van de mitochondriën naar het cytosol wordt getransporteerd, waar het achtereenvolgens door aspartaattransaminase 1 (GOT1), MDH1 en appelzuurenzym 1 (ME1) wordt omgezet in pyruvaat en NADPH. Deze route is van cruciaal belang voor PDAC-cellen om redox-homeostase te behouden en is vereist voor cellulaire proliferatie en tumorgroei in vivo. Daarom kan een inzichtelijk begrip van dit regulerende mechanisme een nieuwe weg openen voor de klinische behandeling van PDAC.
Het onderzoeksteam onder leiding van prof. Zhou Ruhong en prof. Yi Wen van het Zhejiang University College of Life Sciences publiceerde een artikel in het tijdschrift Nature Chemical Biology op 25 juli. Dit artikel onthult dat O-GlcNAcylering bijdraagt aan de groei van alvleesklierkanker door de metabole activiteit van malaatdehydrogenase 1 (MDH1) te reguleren. Deze bevinding heeft enorme implicaties voor de ontwikkeling van geneesmiddelen voor pancreastumoren.
Het team heeft relevant onderzoek gedaan. Hun studie toont aan dat Kras-mutatie cellulaire O-gebonden β-N-acetylglucosamine (O-GlcNAc) induceert, een veel voorkomende vorm van eiwitglycosylering. Malaatdehydrogenase-1 (MDH1), een sleutelenzym in de glutamine-katabole route, wordt positief gereguleerd door O-GlcNAcylering op serine-189 (S189).
Moleculaire dynamische simulaties suggereren dat S189-glycosylering op monomeer MDH1 de stabiliteit van de substraatbindende pocket verbetert en de substraatinteracties versterkt door als moleculaire lijm te dienen. Uitputting van O-GlcNAcylering vermindert de MDH1-activiteit, schaadt het glutaminemetabolisme, maakt PDAC-cellen gevoelig voor oxidatieve stress, vermindert celproliferatie en remt tumorgroei bij naakte muizen. Bovendien zijn de O-GlcNAcylation-niveaus van MDH1 verhoogd in klinische PDAC-monsters.
De identificatie van specifieke routes en eiwitten met een unieke afhankelijkheid van O-GlcNAc is onmisbaar voor het ontwikkelen van gerichte therapieën. De studie van prof. Zhou en prof. Yi et al. onthult dat MDH1-glycosylering klaar is om de unieke Gln-metabole route in PDAC te reguleren, waardoor het potentieel wordt benadrukt om in te grijpen in MDH1-glycosylering als een therapeutische strategie tegen PDAC. + Verder verkennen
Wetenschappers ontdekken molecuul dat alvleesklierkankercellen doodt
 Dynamische hydrogel die wordt gebruikt om zachte robotcomponenten en LEGO-achtige bouwstenen te maken
Dynamische hydrogel die wordt gebruikt om zachte robotcomponenten en LEGO-achtige bouwstenen te maken Productie van drop-in brandstof uit biomassa door microbiële en elektrochemische conversie
Productie van drop-in brandstof uit biomassa door microbiële en elektrochemische conversie Door zelfassemblage geïnduceerde luminescentie van Eu3+-complexen voor bioimaging-toepassing
Door zelfassemblage geïnduceerde luminescentie van Eu3+-complexen voor bioimaging-toepassing Geen trial-and-error meer bij het kiezen van een elektrolyt voor metaal-luchtbatterijen
Geen trial-and-error meer bij het kiezen van een elektrolyt voor metaal-luchtbatterijen Klasse van eiwitten die betrokken zijn bij essentiële celfuncties heeft een onverwachte rol, wetenschappers ontdekken
Klasse van eiwitten die betrokken zijn bij essentiële celfuncties heeft een onverwachte rol, wetenschappers ontdekken
 Onderzoekers onderzoeken hoe bossen veranderen als reactie op de opwarming van de aarde
Onderzoekers onderzoeken hoe bossen veranderen als reactie op de opwarming van de aarde Is er al een groot ijzerbemestingsexperiment aan de gang?
Is er al een groot ijzerbemestingsexperiment aan de gang? Noordoosten hoogste berg registreert windstoot van 171 mph
Noordoosten hoogste berg registreert windstoot van 171 mph Eenvoudige en eenvoudige Science Fair-projecten
Eenvoudige en eenvoudige Science Fair-projecten  Suomi NPP vindt ongeorganiseerde stormen in tropische depressie 29W
Suomi NPP vindt ongeorganiseerde stormen in tropische depressie 29W
Hoofdlijnen
- Familiebanden geven dieren redenen om te helpen of kwaad te doen naarmate ze ouder worden
- Voor deze baleinwalvissen, jagen vereist weinig meer dan watertrappelen
- Hoe de delen van de menselijke schedel te leren
- Geen herten meer in de koplamp:onderzoek toont aan dat grote zoogdieren wel gebruik maken van wegkruisingsconstructies
- Migratie loont voor zangvogels
- Je wandeling is zo duidelijk dat het diepe persoonlijkheidskenmerken kan onthullen
- Een nieuwe manier om mRNA-genomen af te leveren:nucleocapsiden met evolutionaire eigenschappen
- Meer natuurlijk voorkomende bomen en minder clustering kunnen stedelijke bossen ten goede komen
- Ideeën voor een Sunscreen Science Fair Project
- Een theoretische studie verklaart de natuurlijke selectie van eiwitten
- Autonome zelfgenezing gezien in piëzo-elektrische moleculaire kristallen

- Onderzoekers hergebruiken mislukt kankermedicijn in afdrukbare halfgeleider

- Studie vindt fluor als mogelijke vervanging voor lithium in oplaadbare batterijen
- Hoe de pakkingsfractie van een diamantrooster te berekenen

 Japan breekt missie met miniraket kort na lancering af
Japan breekt missie met miniraket kort na lancering af Visteelthouderij
Visteelthouderij  Peptiden die als pil kunnen worden ingenomen
Peptiden die als pil kunnen worden ingenomen De vierkante meters in een driehoek berekenen
De vierkante meters in een driehoek berekenen  Gletsjerijs zal waarschijnlijk records bevatten van de COVID-19-pandemie, onderzoekers zeggen:
Gletsjerijs zal waarschijnlijk records bevatten van de COVID-19-pandemie, onderzoekers zeggen: Flexibel fotonisch kristal van vloeibaar dunnefilmmeta-oppervlak
Flexibel fotonisch kristal van vloeibaar dunnefilmmeta-oppervlak Experts voorspellen een druk Atlantisch stormseizoen, maar niet zoals 2020
Experts voorspellen een druk Atlantisch stormseizoen, maar niet zoals 2020 Aandelen Noble Group stijgen na deal met belangrijke investeerder
Aandelen Noble Group stijgen na deal met belangrijke investeerder
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

